Lernziele
Nach Abschluss dieses Abschnitts sollten Sie in der Lage sein
-
- eine Gleichung zur Darstellung der Bildung einer Seife zu schreiben.
- Bestimmen Sie die Struktur des Fetts, das zur Herstellung einer bestimmten Seife erforderlich ist.
- Bestimmen Sie die Struktur einer Seife, wenn die Struktur des Fetts gegeben ist, aus dem sie hergestellt wird.
- Beschreiben Sie den Mechanismus, durch den Seifen ihre reinigende Wirkung ausüben.
- Erläutern Sie chemisch die Probleme, die bei der Verwendung von Carboxylatseifen in Gebieten mit hartem Wasser auftreten, und erklären Sie, wie diese durch die Verwendung von sulfonathaltigen Reinigungsmitteln überwunden werden können.
Schlüsselbegriffe
Stellen Sie sicher, dass Sie die folgenden Schlüsselbegriffe definieren und im Zusammenhang verwenden können.
- hydrophil
- lipophil (hydrophob)
- amphiphil
- micellös
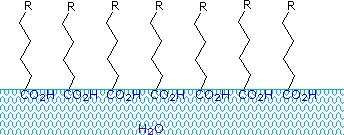
Carbonsäuren und Salze mit Alkylketten, die länger als acht Kohlenstoffe sind, zeigen ein ungewöhnliches Verhalten in Wasser, da sie sowohl hydrophile (CO2) als auch hydrophobe (Alkyl) Bereiche im selben Molekül aufweisen. Solche Moleküle werden als amphiphil (Gk. amphi = sowohl) oder amphipathisch bezeichnet. Fettsäuren, die aus zehn oder mehr Kohlenstoffatomen bestehen, sind nahezu unlöslich in Wasser und schwimmen aufgrund ihrer geringeren Dichte an der Oberfläche, wenn sie mit Wasser vermischt werden. Im Gegensatz zu Paraffin oder anderen Alkanen, die dazu neigen, an der Wasseroberfläche zu puddeln, verteilen sich diese Fettsäuren gleichmäßig über eine ausgedehnte Wasseroberfläche und bilden schließlich eine monomolekulare Schicht, in der die polaren Carboxylgruppen an der Wasseroberfläche wasserstoffgebunden sind und die Kohlenwasserstoffketten vom Wasser weg ausgerichtet sind. Dieses Verhalten ist in der nebenstehenden Grafik dargestellt. Substanzen, die sich an Wasseroberflächen anlagern und die Oberflächeneigenschaften verändern, nennt man Tenside.
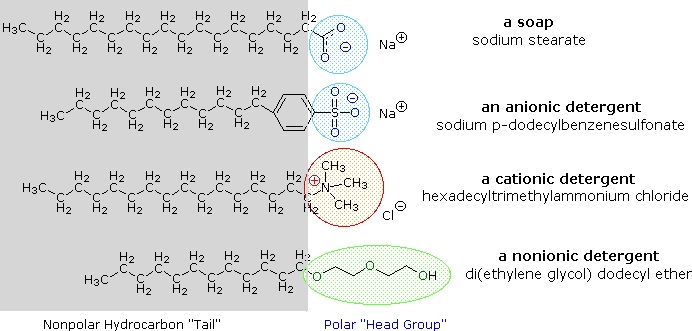
Alkalimetallsalze von Fettsäuren sind in Wasser besser löslich als die Säuren selbst, und der amphiphile Charakter dieser Substanzen macht sie auch zu starken Tensiden. Die gebräuchlichsten Beispiele für solche Verbindungen sind Seifen und Detergenzien, von denen vier unten dargestellt sind. Beachten Sie, dass jedes dieser Moleküle eine unpolare Kohlenwasserstoffkette, den „Schwanz“, und eine polare (oft ionische) „Kopfgruppe“ hat. Die Verwendung solcher Verbindungen als Reinigungsmittel wird durch ihren Tensid-Charakter erleichtert, der die Oberflächenspannung von Wasser senkt, wodurch es in eine Vielzahl von Materialien eindringen und diese benetzen kann.
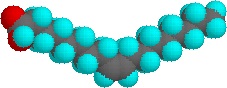
Sehr kleine Mengen dieser Tenside lösen sich in Wasser und ergeben eine zufällige Dispersion gelöster Moleküle. Erhöht man jedoch die Konzentration, tritt eine interessante Veränderung ein. Die Tensidmoleküle lagern sich reversibel zu polymolekularen Aggregaten zusammen, die Mizellen genannt werden. Durch die Zusammenfassung der hydrophoben Ketten im Zentrum der Mizelle wird die Störung der wasserstoffgebundenen Struktur des flüssigen Wassers minimiert, und die polaren Kopfgruppen erstrecken sich in das umgebende Wasser, wo sie an der Wasserstoffbrückenbindung teilnehmen. Diese Mizellen sind oft kugelförmig, können aber auch zylindrische und verzweigte Formen annehmen, wie rechts dargestellt. Hier ist die polare Kopfgruppe durch einen blauen Kreis und der unpolare Schwanz durch eine schwarze Zick-Zack-Linie gekennzeichnet.
Das älteste dem Menschen bekannte amphiphile Reinigungsmittel ist die Seife. Seife wird durch die basenkatalysierte Hydrolyse (Verseifung) von tierischem Fett hergestellt (siehe unten). Bevor Natriumhydroxid kommerziell verfügbar war, wurde eine kochende Lösung von Kaliumcarbonat, das aus Holzasche ausgelaugt wurde, verwendet. Weiche Kaliumseifen wurden dann durch Waschen mit Salzlösung in die härteren Natriumseifen umgewandelt. Die Bedeutung der Seife für die menschliche Zivilisation ist historisch belegt, aber es wurden auch einige Probleme im Zusammenhang mit ihrer Verwendung erkannt. Eines davon wird durch die schwache Acidität (pKa ca. 4,9) der Fettsäuren verursacht. Lösungen von Alkaliseifen sind aufgrund der Hydrolyse leicht alkalisch (pH 8 bis 9). Wird der pH-Wert einer Seifenlösung durch saure Verunreinigungen gesenkt, fallen unlösliche Fettsäuren aus und bilden einen Schaum. Ein zweites Problem wird durch das Vorhandensein von Calcium- und Magnesiumsalzen in der Wasserversorgung (hartes Wasser) verursacht. Diese zweiwertigen Kationen verursachen eine Aggregation der Mizellen, die sich dann als schmutziger Schaum ablagern.
Diese Probleme wurden durch die Entwicklung synthetischer Amphiphile, die Detergenzien (oder Syndets) genannt werden, gelindert. Durch die Verwendung einer viel stärkeren Säure für die polare Kopfgruppe sind die wässrigen Lösungen des Amphiphils weniger empfindlich gegenüber pH-Änderungen. Auch die Sulfonatfunktionen, die für praktisch alle anionischen Detergenzien verwendet werden, verleihen den Mizellen, die die in hartem Wasser vorkommenden Erdalkalikationen enthalten, eine bessere Löslichkeit. Variationen des amphiphilen Themas haben zur Entwicklung anderer Klassen geführt, wie z. B. die oben gezeigten kationischen und nichtionischen Detergenzien. Kationische Detergenzien weisen oft keimtötende Eigenschaften auf, und ihre Fähigkeit, den pH-Wert der Oberfläche zu verändern, hat sie als Weichspüler und Haarspülmittel nützlich gemacht. Diese vielseitigen chemischen „Werkzeuge“ haben den Markt für Haushalts- und Körperpflegeprodukte in den letzten fünfzig Jahren dramatisch verändert
Chemische Reaktionen von Fetten und Ölen
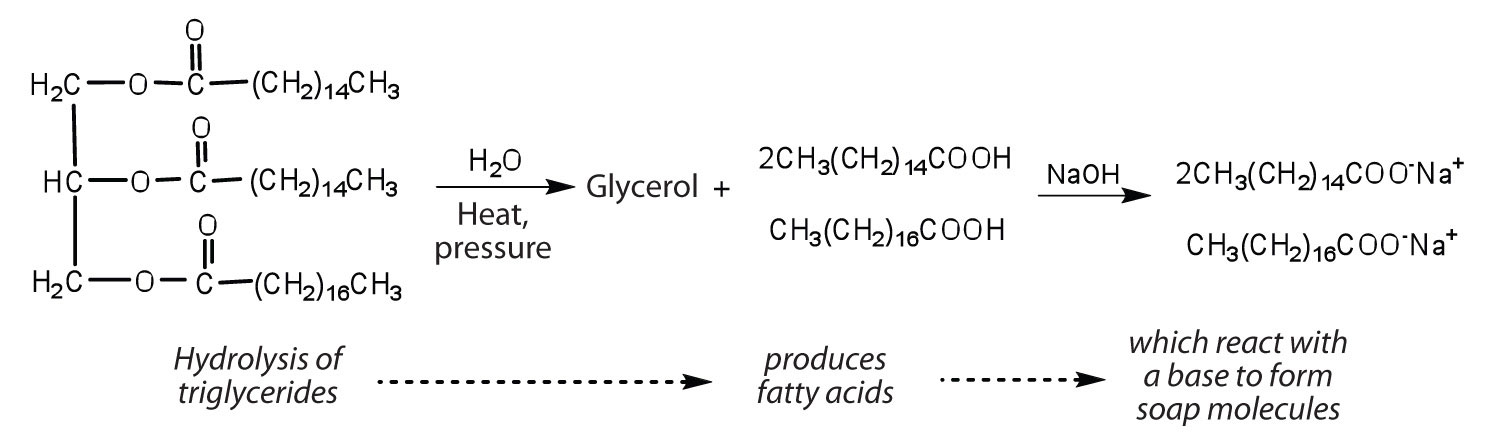
Fette und Öle können an einer Vielzahl chemischer Reaktionen teilnehmen – da Triglyceride beispielsweise Ester sind, können sie in Gegenwart einer Säure, einer Base oder bestimmter Enzyme, die als Lipasen bekannt sind, hydrolysiert werden. Die Hydrolyse von Fetten und Ölen in Gegenwart einer Base wird zur Herstellung von Seife verwendet und wird Verseifung genannt. Heute werden die meisten Seifen durch die Hydrolyse von Triglyceriden (oft aus Talg, Kokosnussöl oder beidem) mit Wasser unter hohem Druck und hoher Temperatur hergestellt. Natriumcarbonat oder Natriumhydroxid wird dann verwendet, um die Fettsäuren in ihre Natriumsalze (Seifenmoleküle) umzuwandeln:
Beiträger und Zuschreibungen
-
Dr. Dietmar Kennepohl FCIC (Professor für Chemie, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, Professor Emeritus (Michigan State U.), Virtuelles Lehrbuch der Organischen Chemie
- The Basics of General, Organic, and Biological Chemistry von David W. Ball, John W. Hill, und Rhonda J. Scott.