Annals of Neurosciences, Volume 15, Issue 4 (October), 2008
Anurag Tripathi1, UC Srivastava2
1Department of Zoology, Ranchi College,(Ranchi University) Ranchi
2Department of Zoology, University of Allahabad, Allahabad, India – 211 002
Korrespondierender Autor
Dr UC Srivastava
Professor of Zoology
Department of Zoology, University of Allahabad
Allahabad, India – 211 002
Phone : 93351 20178
E-Mail : [email protected]
(Eingangsdatum: 08.09.2008)
Abstract
Acetylcholinesterase (AChE) beendet die Neurotransmission an cholinergen Synapsen durch Spaltung des Neurotransmitters Acetylcholin. Die Natur und Didtribution des Enzyms wurde bei vielen Invertebraten und Vertebraten, einschließlich des Menschen, histochemisch und biochemisch eingehend untersucht. Das Enzym zeigt ein hohes Maß an Variabilität in der Verteilung mit seiner bemerkenswerten Anwesenheit auch in nicht-neuronalen Geweben, was ein relevantes Thema für die Untersuchung seiner nicht-klassischen Rolle darstellt.
In letzter Zeit sind viele Informationen über seine dynamische Struktur, Genexpression, seine Rolle in der neuronalen Morphogenese und Synaptogenese herausgekommen. Die Bedeutung von AChE ergibt sich aus der Tatsache, dass es das Ziel von Medikamenten ist, die zur Behandlung von Myasthenia gravis, Glaukom, Alzheimer usw. entwickelt wurden.
In Anbetracht der oben genannten Tatsachen wurde im vorliegenden Artikel ein gründlicher Überblick über die Biochemie, die strukturelle Dynamik, die weite Verbreitung, die Isoformen und die Auswirkungen auf neurodegenerative Erkrankungen gegeben.
Schlüsselwörter: Acetylcholinesterase, Cholinerge, Molekulare Formen, Neurodegenerative Erkrankungen, Alzheimer-Krankheit.
Einführungen
Acetylcholinesterase ( AChE) ist eines der effizientesten Enzyme des Nervensystems, das an den cholinergen Synapsen und an neuromuskulären Synapsen konzentriert ist, wo es den Neurotransmitter Acetylcholin (Ach) schnell in Cholin und Acetat hydrolysiert und damit eine wesentliche Rolle in der cholinergen Neurotransmission spielt.
Der Begriff Acetylcholinesterase wurde 1949 von Augustintion und Nachmansohn für eine spezifische Cholinesterase eingeführt, die Acetylcholin schneller als andere Esterasen hydrolysieren kann. 1964 empfahl die Kommission für Enzymologie den Namen „Acetylcholinesterase“ (Acetylcholin-Acetyl-Hydrolase; 3.1.1.7) für eine echte und spezifische Cholinesterase.
Die Verteilung des Enzyms in den zentralen und peripheren Nervengeweben verschiedener Wirbeltiere zeigt eine hohe Variationsbreite (1-13). Es wurde auch in nicht neuronalen Geweben und Gliazellen lokalisiert (14, 15). Das Enzym weist auch eine molekulare Vielfalt mit seinen sechs verschiedenen molekularen Formen und struktureller Dynamik auf, was seine Affinität und Wirkung mit verschiedenen Legenden erleichtert (16-17). Darüber hinaus werden AChE mehrere nicht-klassische Rollen unabhängig von seiner katalytischen Funktion, d.h. der Hydrolyse von Ach, zugeschrieben. Diese klassischen und nicht-klassischen Rollen von AChE veranschaulichen sein weites Vorkommen in neuronalen und nicht-neuronalen Geweben (18-20).
Die Bedeutung von AChE in der Körperhomöostase wird durch die Tatsache unterstrichen, dass sie die Ziele einiger der stärksten Toxine einschließlich Insektiziden, Schlangengift und chemischen Waffen sind (21).
Daher bieten eine solch weite Verbreitung und verschiedene Funktionen, molekulare Formen, strukturelle Dynamik etc.
Die weite Verbreitung und die verschiedenen Funktionen, molekularen Formen, Strukturdynamik etc. von AChE bieten daher eine ausreichende Grundlage, um es als vielseitiges Enzym zu bezeichnen, dessen detaillierte Kenntnis helfen wird, spezifische Medikamente zur Bekämpfung verschiedener neurodegenerativer Erkrankungen zu entwickeln, die mit diesem Enzym in Verbindung stehen.
Biochemie und Strukturdynamik
Die dreidimensionale Struktur von AChE wurde erstmals 1991 von Joel Sussman et.al. anhand des Proteins aus T. californica bestimmt (22). Die Strukturen der katalytischen Domänen der AChEs aus Spezies wie T. californica, Maus und Mensch sind recht ähnlich (Abb.1) (23, 24).
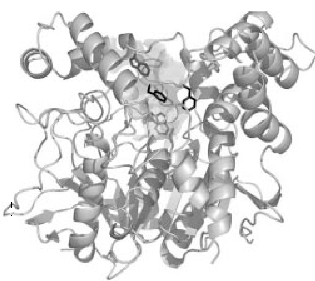
Abbildung 1. Dreidimensionales Banddiagramm der Acetylcholinesterase von Torpedo Californica.
Acetylcholinesterase ist eine Serinhydrolase, die zur Familie der Corboxylesterasen vom Typ B in höheren Eukaryoten gehört. Es handelt sich um ein ellipsoides Molekül von ca. 45× 60×65 A0, das aus einem 12-strängigen gemischten Beta-Sheet besteht, das von 14 Alpha-Helices umgeben ist. (22). In seinem natürlichen Zustand ist es ein Monomer mit einem Molekulargewicht von etwa 60.000 und bildet Aggregate, die weiterhin katalytische Aktivität erzeugen.
Das aktive Zentrum besteht aus zwei Unterseiten, der esterischen Unterseite mit der katalytischen Triade (Ser-His-Glu) und der peripheren bindenden anionischen Unterseite (PAS), die den positiven quaternären Pol von Ach beherbergt. ( Abb. 2a)
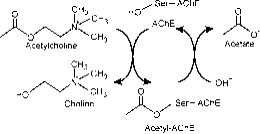
Abbildung 2a: Verschiedene Stellen von AChE; die katalytische Stelle befindet sich in einer tiefen Schlucht.
Die esterische Unterseite enthält die katalytische Maschinerie des Enzyms, eine Triade aus Ser 200, His-440 und Glu-327 (die Zahlen bezeichnen die Reihenfolge der Aminosäuren in der Polypeptidkette). Diese Triade ähnelt anderen Serinproteasen mit der Ausnahme, dass die Triade als erstes Glu als drittes Mitglied aufweist, im Gegensatz zu Asp. Darüber hinaus ist die Triade von entgegengesetzter Händigkeit zu der der anderen Proteasen. Das anionische Subit wird durch Trp 84, Phe 330, Phe 331 definiert. Seine Aufgabe ist es, den geladenen Teil des Substrats, das in das aktive Zentrum eintritt, zu orientieren. Dies wird hauptsächlich von Trp. 84 (22).
Die aromatische Schlucht im Protein ist etwa 20 Angström tief und durchdringt die Hälfte des Enzyms. Die aktive Stelle liegt an der Basis dieser Schlucht nur 4 Angström oberhalb der Basis. Aromatische Schlucht ist der passendere Begriff, da 40% der Auskleidung aus 14 aromatischen Resten besteht, die bei verschiedenen Spezies von AChE hoch konserviert sind (25).
Die periphere anionische Stelle hat die Fähigkeit, an viele verschiedene Arten von Liganden zu binden, wodurch sie die Bestätigung der aktiven Stelle beeinflusst. Sechs Reste stabilisieren die Aktivität innerhalb der Site. Trp 286, Ty r 72, Tyr 124, Glu 285, Asp 74, Tyr 341 befinden sich auf der gegenüberliegenden Seite des Schluchteingangs. Diese Anordnung der Reste bietet eine Flexibilität, die viele Liganden beherbergt und auch ihre Bestätigungsmobilität impliziert. AChE katalysiert die Hydrolyse von AChE auf folgende Weise (Abb. 2b):
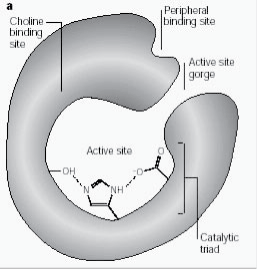
Abbildung 2b: Enzymsubstratreaktion zur Veranschaulichung der Acetylcholin-Hydrolyse.
Die molekulare Dynamik von AChE wird durch einen Cross-Talk-Mechanismus aufrechterhalten, bei dem eine Interaktion zwischen zwei Subsites stattfindet, insbesondere zwischen den Resten Trp 286 und Trp 86. Wenn Trp 286 an der Peripherie gebunden ist, beeinflusst es Trp 86 im aktiven Zentrum und verursacht eine unterschiedliche Bestätigungsstelle. Asp 74 spielt ebenfalls eine Rolle bei der allosterischen Modulation des Enzyms. Die Empfindlichkeit dieser Reste und die Plastizität des aktiven Zentrums sind wahrscheinlich das Ergebnis eines evolutionären Designs, das darauf abzielt, eine optimale Aktivität unter einer Vielzahl von Bedingungen zu verleihen (26.)
Vorkommen
Das Enzym AChE ist in hoher Konzentration in allen Arten von leitendem Gewebe vorhanden, in Nerven und Muskeln, in zentralen und peripheren Geweben, in motorischen und sensorischen Fasern, in sympathischen und parasympathischen, sogenannten cholinergen und nicht-cholinergen Fasern und in allen Regionen, in denen sich Zellkörper und Verzweigungen befinden (27). Mit histochemischen Methoden wird AChE generell in neuronalen Strukturen nachgewiesen: Perikarya, Oberflächenmembranen, Axone, Dendriten und synaptische Regionen 4, 15, 28-30). Die Aktivität von AChE ist in motorischen Neuronen höher als in sensorischen Neuronen (4, 15, 31). Es ist allgemein anerkannt, dass Acetylcholinesterase im Nervengewebe Neuronen repräsentiert, die Acetylcholin als Neurotransmitter enthalten und vermutlich auch freisetzen (32).
Frühe Untersuchungen des Syntheseortes von AChE im Nervengewebe wiesen auf einen Ursprung im Zellkörper des Neurons hin (33-35). Es wurde festgestellt, dass das Enzym mit dem endoplasmatischen Retikulum des Zellkörpers und dem Golgi-Apparat assoziiert ist (8, 36). AChE wurde auch in subzellulären Fraktionen des Gehirns mit mikrosomalen und rohen mitochondrialen Fraktionen assoziiert (2, 37). Eine weitere Fraktionierung der rohen mitochondrialen Fraktion aus Hirngewebe zeigte hohe AChE-Aktivität in der synaptosomalen Membranfraktion (6).
Der Großteil von AChE wurde in den Axonen lokalisiert und mit der axonalen Membran assoziiert (9). Cholinesterase-Aktivität, die auf Axone beschränkt ist, wurde auf axonalen Vesikeln aller unmyelinisierten und einiger myelinisierter Nervenfasern beobachtet (38). Myelinisierte Nervenfasern haben im Allgemeinen eine geringere Konzentration als die so genannten unmyelinisierten und die weiße Substanz enthält viel weniger AChE als die graue Substanz (27). In isolierten Motoneuronen ist die AChE-Aktivität im Zytoplasma, den Dendriten und Axonen etwa zehnmal größer als im Nukleoplasma und im Nukleolus ist keine Aktivität vorhanden (39). Es wurde gezeigt, dass Gliazellen AChE in unterschiedlichen Konzentrationen enthalten (14, 15)
Klassische und nicht-klassische Rollen
Der gesamte Ablauf der cholinergen Übertragung insbesondere an der neuromuskulären Verbindung, nämlich die Freisetzung von Ach, seine Diffusion über den synaptischen Spalt, seine reversible Interaktion mit dem nikotinischen Ach-Rezeptor und schließlich die Hydrolyse durch AChE erfolgt innerhalb weniger Millisekunden. Der gesamte Prozess ist sowohl räumlich als auch zeitlich eng integriert (40). Entsprechend seiner klassischen Rolle beträgt seine Turnover-Zeit 150 usec, was der Hydrolyse von 5000 Ach-Molekülen/Molekül des Enzyms/sec entspricht. Es hydrolysiert das Substrat so schnell, dass die Konzentration um das Enzymmolekül herum relativ zur Konzentration in der Bulk-Lösung abnimmt.
Seit über zwanzig Jahren wird vermutet, dass AChE neben seiner klassischen Rolle bei der Beendigung der synaptischen Übertragung noch weitere Funktionen hat. Solche nicht klassischen Funktionen von AChE könnten die Hydrolyse von Ach in einem nicht synaptischen Kontext beinhalten. Das 26 Reste umfassende C-terminale Peptid ARP (Acetylcholinesterase-Read-Through-Peptid) von humanem AChE, das produziert wird, wenn die R-Spleißvariante durch Stress induziert wird, wurde berichtet, dass es die hämatopoetische Differenzierung moduliert (41).
Verschiedene in vivo und in vitero Studien im Zentralnervensystem deuten darauf hin, dass das entwicklungsregulierte AChE-Enzym eine Rolle bei nicht-cholinergen Funktionen wie morphometrischen Prozessen, Zelldifferenzierung und Synaptogenese im Nervensystem spielt (20).Es gibt zahlreiche Studien, die darauf hinweisen, dass eine der nicht-klassischen Rollen von AChE die eines Adhäsionsproteins sein könnte, das an der Entwicklung und Erhaltung von Synapsen beteiligt ist (42). Einige andere Beweise implizieren AChE als Knochenmatrixprotein, und es wurde kürzlich gezeigt, dass es mit dem Basalprotein Laminin interagiert (43, 44).
Verschiedene Studien haben gezeigt, dass AChE am Neuritenwachstum beteiligt ist. Formen von AChE, die Ach hydrolysieren, denen aber die corboxy-terminalen (verantwortlich für die neuritogenen Aktivitäten), neuritischen Domänen fehlten, konnten das Neuritenwachstum nicht steigern, was die Unabhängigkeit der katylitischen und neuritogenen Aktivität voneinander zeigt (19). Es wurde auch vorgeschlagen, dass AChE mehrere Rollen in der Embryogenese spielt. Zebrafische bieten ein hervorragendes System, um die invivo-Rollen von AChE während der Embryogenese zu untersuchen. Es wurde eine Missence-Mutation im ache-Gen des Zebrafisches identifiziert, die die Ach-Hydrolyse aufhebt, aber den neuritogenen Corboxy-Terminus intakt lässt (45). Bei den ache-mutierten Embryonen wurden auch Defekte in der Muskelfaserentwicklung und im Überleben und dendritischen Wachstum der primären sensorischen Neuronen festgestellt. Diese Defekte wurden kollektiv interpretiert, um eine nicht-klassische Rolle von AChE zu unterstützen.
Es gibt zahlreiche Beweise, die seine Rolle bei der Hydrolyse von Substanz P, Met, Leu-Encephalin und dem Abbau anderer Neuropeptide unterstützen (46, 47).
AChE wurde auch vorgeschlagen, in der Herzmorphogenese zu funktionieren. AChE-Aktivität wird in embryonalen Ratten- und Hühnerherzen vor der Innervation nachgewiesen (48, 49). Obwohl seine Rolle im embryonalen Herzen unklar ist, wurde vorgeschlagen, dass AChE das embryonale Reizleitungssystem reguliert (50). Es sind jedoch zusätzliche Funktionen erforderlich, um die Rolle von AChE in der Herzfunktion weiter zu erforschen.
AChE hat gezeigt, dass es den Zusammenbau von αβ-Peptid zu Amyloidfibrillen wahrscheinlich durch Interaktion an der Peripherie beschleunigt (51-53).Es wurde auch gezeigt, dass AChE / αβ-Komplexe im Vergleich zu Fibrillen, die nur αβ enthalten, eine erhöhte Neurotoxizität aufweisen (54).
Im pharmakologischen Kontext zeigten die Studien, dass die nicht klassischen Aktivitäten von AChE an der peripheren anionischen Stelle zu konvergieren scheinen. Es ist daher denkbar, dass in Zukunft neue Kategorien von AChE-Inhibitoren entwickelt werden.
Molekulare Diversität
Das Enzym AChE kommt in einer Reihe von molekularen Formen vor, die sich sowohl in der quaternären Struktur als auch in der Art der Verankerung innerhalb der Synapse unterscheiden und durch das alternative Spleißen des C-terminalen Exons eines einzelnen Gens, gefolgt von posttranslationaler Modifikation, entstehen (55, 56). Acetylcholinesterase (AChE) liegt in sechs verschiedenen Formen (Isoenzymen) vor, nämlich als globuläres Monomer (G1), Dimer (G2) und Tetramer (G4); Tetramer mit Schwanz (A4), Tetramer mit doppeltem Schwanz (A8) und Tetramer mit dreifachem Schwanz (A12) (Abb. 3). Die rationellste Terminologie, die auf diesen Informationen basiert, ist die von Bon et al. (1982) entwickelte. In ihrem System werden die globulären Formen mit „G“ und die tailed-Formen mit „A“ bezeichnet.
Monomer- und Disulfid-verknüpfte Dimmer-Formen können löslich sein oder durch ein Glycophospholipid an eine Membran gebunden sein. Die Tetramer-Formen können löslich, über ein Lipid an eine Membran gebunden oder an eine Kollagen-Tripelhelix gebunden sein. Monomere Formen werden im Allgemeinen in Synapsen des Zentralnervensystems von Wirbeltieren eingebaut, während an den neuromuskulären Knotenpunkten drei katalytische Untereinheiten von Tetrameren an einen dreifach helikalen Kollagenschwanz gebunden sind, der dann an der Basallamina im synaptischen Spalt verankert ist.
Die Expression der molekularen Formen von AChE in Torpedo erwies sich als gewebespezifisch, was darauf hindeutet, dass der Polymorphismus von AChE von einer Reihe von Faktoren abhängt, einschließlich
der Menge an freigesetztem Ach
der Größe des synaptischen Spalts und/oder
dem zeitlichen Verlauf der physiologischen Stimulation.(58)
Regulation der AChE-Expression in Neuronen
In den letzten Jahren wurden umfangreiche Studien durchgeführt, um die molekularen Mechanismen und Wege zu entschlüsseln, die an der Expression und Lokalisation von AChE in neuronalen und nicht-neuronalen Geweben beteiligt sind. AChE wird während der neuronalen Differenzierung stark exprimiert. Es wurde beobachtet, dass die AChE – 3′ untranslatierte Region (UTR) ein AU-reiches Element (ARE) enthält, das direkt mit dem RNA-Bindungsprotein ‚HuD‘ interagiert, was zur Fülle von AChE-Transkripten in neuronalen Zellen führt (59). Diese Befunde zeigen die Bedeutung posttranskriptioneller Mechanismen bei der Regulierung der AChE-Expression in sich differenzierenden Neuronen und implizieren ‚HuD‘ als einen wichtigen transaktiven Faktor in diesen Vorgängen. Darüber hinaus gibt es jedoch noch weitere regulatorische Faktoren, die die Stabilität, Lokalisation und Translation von AChE-Transkripten steuern. Viele cis wirkende Elemente und trans wirkende Faktoren und Proteine interagieren mit dem AChE – 3′-UTR. (59).
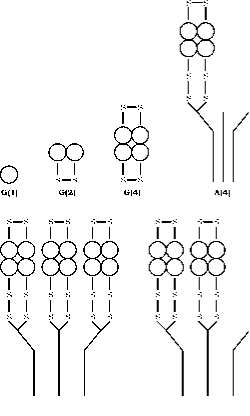
Abbildung 3. Quaternäre Struktur der sechs Hauptformen von AChE. Globuläre Formen sind mit G und asymmetrische Formen mit A dargestellt, nach dem Schema von Bon et. al. (16). Die Lage der Disulfidbrücken und die Art der Bindung an den Kollagenschwanz sind nach dem Modell von Anglister und Silman dargestellt.(57)
AChE bei neurodegenerativen und neuromuskulären Erkrankungen :
Acetylchlinesterase wurde direkt mit bestimmten neuromuskulären Erkrankungen wie Myasthenia gravis, Glaukom (60) und neuerdings auch mit dem cholinergen Mangel bei Morbus Alzheimer (61) in Verbindung gebracht.
Klinisch gesehen ist eine moderate Hemmung von AChE bei der Behandlung dieser Krankheiten wirksam, um die Wirkung von ACh auf den Rezeptor zu verlängern. Eine solche Behandlung ist wünschenswert, wenn entweder eine verminderte Konzentration von ACh vorliegt, wie im Fall der Alzheimer-Krankheit, oder wenn weniger Rezeptoren vorhanden sind, wie im Fall der Myasthenia gravis. Die derzeit in den USA von der FDA zugelassenen Hemmstoffe zur Behandlung der Alzheimer-Krankheit sind E2020 (Donepezil, Aricept), Tacrine (Cognex), Rivastigmin (Exelon) und Galantamin (Reminyl)(62). Zu den Inhibitoren zur Behandlung der Myasthenia gravis gehören Pyridostigmin (Mestinon) und Neostigmin (Prostigmin)(63). Eine überwältigende Hemmung von AChE, insbesondere durch kovalente Bindung an das Serin im aktiven Zentrum, ist jedoch immer tödlich. Daher ist AChE ein Hauptangriffsziel für natürlich vorkommende Toxine wie das Schlangengift Fasciculin II, Pestizide wie Parathion und Malathion und chemische Kampfstoffe wie Sarin, Tabun und VX (64)
Schlussfolgerungen
Im vorliegenden Artikel haben wir zunächst einen Überblick über die jüngsten Ergebnisse in Bezug auf die Biochemie und die molekulare Struktur von AChE gegeben, die dem einzigartigen Enzym die Flexibilität verleiht, verschiedenen Legenden zu begegnen und auch eine hohe Turnover-Rate zu zeigen. Wir haben auch sein breites histochemisches Verteilungsmuster in den neuronalen und nicht neuronalen Geweben illustriert, das weiter mit seinen klassischen und nicht klassischen Rollen korreliert werden kann, die überprüft wurden. Weitere Studien über die Regulation der AChE-Expression, die die Bedeutung dieser posttranskriptionellen Ereignisse in vivo entschlüsseln, sind von größter Bedeutung, da diese letztlich zur Entwicklung zusätzlicher therapeutischer Strategien führen könnten, die auf die Förderung der neuronalen Regeneration und des Überlebens abzielen. Die jüngsten Entwicklungen in der AChE-Biologie, insbesondere ihre Auswirkungen auf bestimmte neurodegenerative Erkrankungen, sind von zentralem Interesse und wurden kurz besprochen. Diese Forschung führt zu neuen Klassen von AChE-Inhibitoren, die gegen seine PAS (periphere anionische Stellen) gerichtet sind und die im Zusammenhang mit der Alzheimer-Krankheit eine doppelte Rolle spielen könnten, indem sie gleichzeitig die Acetylcholin-Hydrolyse hemmen und die Assemblierung desá â-Peptids zu Amyloidfasern verzögern.
Abkürzungen
AChE – Acetylcholinesterase; ARP – Acetylcholinesterase read through peptide; Ach – Acetycholin; UTR – untranslatierte Region; ARE – AU rich element; PAS – periphere anionische Stelle; Glu – Glutaminsäure; His – Histidin; Ser – Serin; Asp – Asparaginsäure; Trp – Tryptophan; Tyr – Tyrosin; Phe – Phenylalanin.