Die adaptive Servo-Ventilation (ASV) ist eine nicht-invasive Beatmungstherapie, die einen variablen inspiratorischen positiven Atemwegsdruck (IPAP) bereitstellt, um die Inspiration zu unterstützen, wenn die Atemamplitude reduziert ist, und eine ausreichende Atmung sicherstellt, wenn die Atemanstrengung fehlt, sowie einen festen oder variablen endexpiratorischen PAP (EPAP) bereitstellt, um die Durchgängigkeit der oberen Atemwege aufrecht zu erhalten. Dieser Ansatz ist so konzipiert, dass er das nasale kontinuierliche PAP (CPAP) in Bezug auf die pneumatische Öffnung der oberen Atemwege nachahmt und zentrale Schlafapnoen direkt unterdrückt, ohne eine Überventilation zu verursachen.1 Bei hypokapnischer zentraler Schlafapnoe (CSA), bei der Hyperventilation eine große Rolle spielt, hat sich gezeigt, dass ASV bei Patienten mit Herzinsuffizienz (HF) den Kohlendioxidgehalt leicht erhöht.1
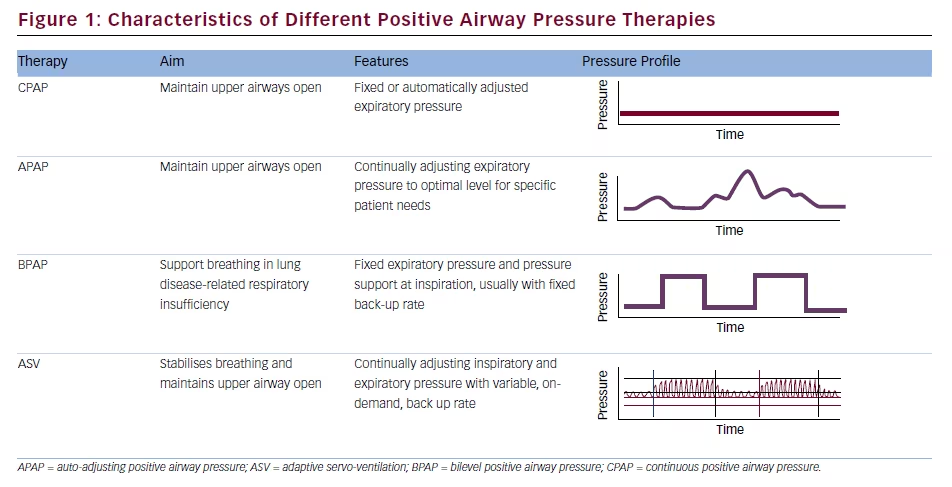
Das von ASV-Geräten bereitgestellte Druckprofil unterscheidet sich von dem anderer PAP-Therapien (siehe Abbildung 1). Obwohl Standardeinstellungen verfügbar sind, ist eine schlaflaborgestützte individuelle Titration für jeden Patienten angemessener,2 und der beste Ansatz, um den Patientenkomfort aufrechtzuerhalten, die Adhärenz zu maximieren und die Hämodynamik zu erhalten, ist die Verwendung minimaler effektiver Einstellungen für IPAP, EPAP und Back-up-Rate.3
Neueste Studiendaten zur Adaptiven Servo-Ventilation
Im Allgemeinen stammen die Daten zur Verwendung von ASV-Geräten aus kleinen und/oder unkontrollierten Studien und hauptsächlich aus Schlafkliniken. Dies änderte sich kürzlich mit der Veröffentlichung der Ergebnisse der SERVE-HF-Studie.4
SERVE-HF war die erste langfristige, randomisierte, kontrollierte, internationale, multizentrische Phase-IV-Studie, die die Auswirkungen der Zugabe von ASV zur leitliniengerechten medizinischen Behandlung im Vergleich zur alleinigen medizinischen Behandlung (Kontrolle) auf das Überleben und die kardiovaskulären Ergebnisse bei Patienten mit symptomatischer HF und reduzierter Ejektionsfraktion (EF) (HFrEF; EF ≤45 %), die eine vorherrschende CSA hatten, untersuchte. Die Fähigkeit der ASV-Therapie, den Apnoe-Hypopnoe-Index (AHI) signifikant zu reduzieren und die Sauerstoffsättigung sowie andere Parameter der schlafbezogenen Atmung (SDB) zu verbessern, wurde in der SERVE-HF-Studie bestätigt, aber diese Effekte schlugen sich nicht in verbesserten klinischen Ergebnissen nieder.4
Erwartungsgemäß waren die Studienergebnisse für den primären Endpunkt – erstes Ereignis des Kompositums Tod aus beliebiger Ursache, eine lebensrettende kardiovaskuläre Intervention (definiert als Herztransplantation,
Implantation eines langfristigen Herzunterstützungssystems, Reanimation nach plötzlichem Herzstillstand oder adäquater Schock bei ventrikulärer Arrhythmie bei Patienten mit implantiertem Kardioverter-Defibrillator) oder eine ungeplante Krankenhauseinweisung wegen einer Verschlechterung der HF – mit einer Hazard Ratio (HR) von 1.13 (95 % Konfidenzintervall 0,97, 1,32; p=0,113).4 Vielleicht noch überraschender war die Identifizierung eines Sicherheitssignals in der ASV-Gruppe, wobei die mit dem Gerät behandelten Patienten ein höheres Risiko für einen Gesamttod (HR 1,28, 95 % CI 1,06, 1,55; p=0,01) und einen kardiovaskulären Tod (HR 1,34, 95 % CI 1,09, 1,65; p=0,006) hatten.4 Es gab keine signifikanten Unterschiede zwischen der ASV- und der Kontrollgruppe in Bezug auf Symptome, Belastbarkeit oder Lebensqualität. Die Auswirkungen von ASV auf die Blutgase, die linksventrikuläre EF und Biomarker werden in der großen Teilstudie SERVE-HF (NCT01164592) untersucht,5 deren Ergebnisse in Kürze vorliegen werden. Diese Daten können dazu beitragen, die Hauptergebnisse von SERVE-HF besser zu erklären.
Obwohl die Ergebnisse von SERVE-HF einen Paradigmenwechsel für ASV darstellen, sind sie nur auf eine Untergruppe von mit ASV behandelten Patienten anwendbar (d.h. solche mit HFrEF und vorherrschender CSA), und es gibt keine Hinweise darauf, dass diese Therapie nicht mehr in Betracht gezogen werden sollte. ASV wurde auch bei anderen Indikationen untersucht, und die zunehmende Zahl von Hinweisen deutet darauf hin, dass ASV bei einer Reihe von Patientengruppen außerhalb von HFrEF eine Rolle spielen könnte.
Adaptive Servo-Ventilation bei Herzinsuffizienz mit erhaltener Ejektionsfraktion
Obwohl die negative prognostische Auswirkung von HF mit erhaltener EF (HFpEF) der von HFrEF ähnlich ist,6 stellen die beiden Formen von HF unterschiedliche klinische Syndrome dar und sollten daher getrennt untersucht und behandelt werden.7 HFpEF tritt häufiger bei Frauen auf und hat häufiger eine nicht-ischämische Ätiologie,6,8 und es gibt derzeit keine evidenzbasierten Behandlungsmöglichkeiten.8 Darüber hinaus gibt es wichtige Unterschiede zwischen HFpEF und HFrEF in Bezug auf die Schärfe und das Ausmaß der myokardialen Dysfunktion, die Muster des Umbaus in den Herzkammern und auf ultrastruktureller Ebene sowie das Ansprechen auf therapeutische Interventionen.7 Aufgrund dieser Unterschiede ist zu erwarten, dass sich die Ergebnisse der ASV-Therapie bei Patienten mit HFpEF von denen der SERVE-HF-Studienpopulation mit HFrEF unterscheiden.
Die Ergebnisse zweier kleinerer Studien9,10 mit Nachbeobachtungszeiträumen von 12 bzw. 18 Monaten deuten darauf hin, dass die positiven Effekte der ASV bei Patienten mit HFpEF über Verbesserungen des AHI und der Schlafparameter hinausgehen könnten. In einer Studie wurden HFpEF-Patienten mit Cheyne-Stokes-Atmung (CSR), die mit ASV behandelt wurden (n=39), mit ähnlichen Patienten, die ASV aus verschiedenen Gründen ablehnten (n=21), über einen Nachbeobachtungszeitraum von 3-24 (Mittelwert 11,6) Monaten verglichen.9 Die Ergebnisse der Schlafstudien zeigten, dass ASV im Vergleich zu den Kontrollen den AHI, die längste Apnoe und Hypopnoe sowie die maximale Entsättigung signifikant reduzierte. Darüber hinaus wiesen die Patienten in der ASV-Gruppe im Vergleich zur Kontrollgruppe bei kardiopulmonalen Belastungstests signifikante Steigerungen der maximalen Sauerstoffaufnahme (absoluter Wert und prozentuale Vorhersage), der Sauerstoffaufnahme an der aerob-anaeroben Schwelle und des Sauerstoffpulses auf. Es wurden auch signifikante Verringerungen des linken Vorhofdurchmessers und der Spitzengeschwindigkeit des frühen Doppler-Mitraleinstroms (E)/Spitzengeschwindigkeit des atrialen Doppler-Mitraleinstroms (A) sowie signifikante Erhöhungen von A, der mittleren frühen diastolischen Verlängerungsgeschwindigkeit (e‘) und E/e‘ berichtet.
In einer randomisierten Studie, die 36 stabile HFpEF-Patienten mit zentraler SDB einschloss, wurde die kardiale Ereignisrate zwischen Patienten, die nur eine optimierte medikamentöse Behandlung erhielten, und Patienten, die eine optimierte medikamentöse Behandlung plus ASV erhielten, verglichen (mittleres Follow-up 543 Tage). Ein kardiales Ereignis war definiert als kardialer Tod oder Rehospitalisierung wegen HF-Dekompensation. Im Verlauf der 6-monatigen Behandlung hatten HFpEF-Patienten in der ASV-Gruppe eine höhere ereignisfreie Rate (94,4 %) als in der Gruppe ohne ASV (61,1 %; p10 Signifikant größere Verbesserungen gegenüber dem Ausgangswert wurden auch bei den B-Typ-natriuretischen Peptidspiegeln und der New York Heart Association (NYHA)-Funktionsklasse in den ASV-Gruppen im Vergleich zu denen ohne ASV dokumentiert, aber es gab keine signifikante Veränderung der echokardiographisch bestimmten linksventrikulären EF vom Ausgangswert bis zu den 6 Monaten. Aus Sicht der SDB betrug die Reduktion des AHI gegenüber dem Ausgangswert 30,2/h in der ASV-Gruppe gegenüber 8.2/h in der Gruppe ohne ASV (p10
Es ist möglich, dass die erhöhte Rate an plötzlichem Herztod, die mit der ASV-Behandlung von CSA bei Patienten mit HFrEF assoziiert ist, die in SERVEHF4 identifiziert wurde, bei HFpEF anders sein könnte, wo das zugrundeliegende Risiko für plötzlichen
Herztod geringer ist. Zur definitiven Beantwortung dieser Frage sind jedoch größere Langzeitstudien mit harten klinischen Outcomes (z. B. Mortalität) erforderlich. Bis solche Daten vorliegen, muss die Entscheidung, ob ASV zur Behandlung von CSA bei Patienten mit HFpEF eingesetzt werden soll, auf individueller Patientenbasis unter Leitung eines Kardiologen getroffen werden (Empfehlung zur Überwachung der ASV-Therapie siehe unten).
Adaptive Servo-Ventilationstherapie bei Schlafapnoe
Treatment-emergent Central Sleep Apnoea
Treatment-emergent CSA, früher bekannt als komplexe Schlafapnoe, tritt bei etwa 5-15 % der Patienten auf, die sich einer PAP-Titration für obstruktive Schlafapnoe (OSA) unterziehen. Die Definition von behandlungsbedingter CSA ist die Persistenz oder das Auftreten von zentralen Apnoen und Hypopnoen während der Einleitung einer PAP-Therapie ohne Backup-Atemfrequenz für OSA, trotz signifikanter Auflösung der obstruktiven respiratorischen Ereignisse.11 Bei den meisten Patienten ist behandlungsbedingte CSA ein vorübergehendes Phänomen, das im Laufe der Zeit nicht stabil ist.12-14 Eine mögliche Erklärung ist, dass die mit der CPAP-Titration verbundene Schlaffragmentierung und Schlafstadienverschiebung eine Instabilität der Beatmungskontrolle verursacht. Diese Vermutung wird durch die Feststellung gestützt, dass behandlungsbedingte CSA häufiger in Nächten auftritt, in denen CPAP-behandelte Patienten schlecht schlafen.12 Andere prädisponierende Faktoren könnten das Vorliegen einer koronaren Herzkrankheit, vorbestehende zentrale Apnoen, der Schweregrad der OSA und die Einnahme von Opioiden sein.12,14 Eine Behandlung ist jedoch für die Untergruppe von Patienten mit behandlungsbedingter CSA erforderlich, die bei fortgesetzter Anwendung von CPAP oder bilevel PAP (biPAP) ohne Backup-Frequenz bestehen bleibt. In solchen Situationen ist ASV die am besten geeignete Therapie.
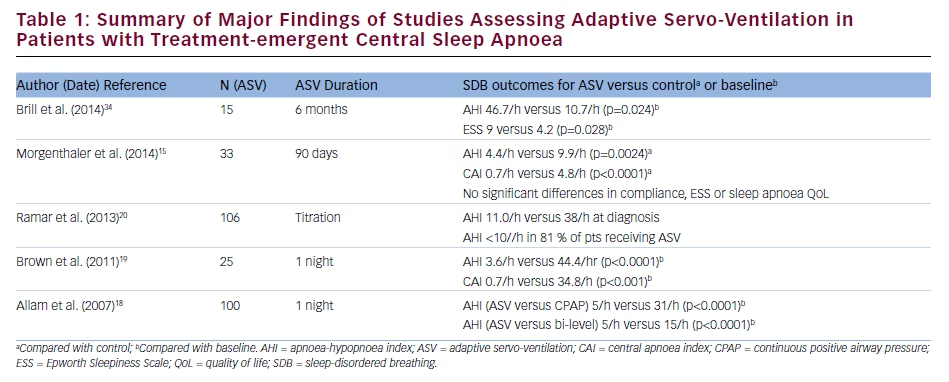
Die Auswirkungen von ASV auf die klinischen und polysomnographischen (PSG) Ergebnisse bei Patienten mit behandlungsbedingter CSA wurden in einer prospektiven, randomisierten klinischen Studie mit 66 Patienten mit denen von CPAP verglichen.15 Nach zwei Nächten der Titration lag der AHI in der ASV-Gruppe bei 5,7/h gegenüber 14,1/h in der CPAP-Gruppe (p≤0,0003); die entsprechenden Werte nach 90 Tagen Behandlung lagen bei 4,4/h und 9,9/h (p=0,0024). Der CAI lag nach der Titration bei 1,1/h mit ASV und 8,8/h mit CPAP (p≤0,0003), und nach 90 Tagen bei 0,7/h bzw. 4,8/h (p16 Zu den positiven Effekten von ASV in einer multizentrischen, prospektiven Beobachtungsstudie mit 27 Patienten mit CSA oder behandlungsbedürftiger CSA gehörten Verbesserungen des AHI, des CAI, des obstruktiven Apnoe-Index und des Arousal-Index während der Titration der Therapie, Veränderungen, die über 3 Monate der Behandlung beibehalten wurden.17 Darüber hinaus gab es eine signifikante Reduktion des Epworth Sleepiness Scale (ESS)-Scores während der ASV (von 12,8 bei Studienbeginn auf 7,8; p=0,001); die mittlere ASV-Adhärenz betrug 4,2 h/Nacht. Diese Daten werden durch die Ergebnisse retrospektiver Analysen gestützt, die zeigen, dass ASV im Hinblick auf die Senkung des AHI und die Verbesserung der Schlafqualität bei Patienten mit behandlungsbedürftiger CSA wirksamer ist als andere PAP-Therapien.18-20 Eine Zusammenfassung der Ergebnisse von Studien, die den Einsatz von ASV bei Patienten mit behandlungsbedingter CSA untersuchten, ist in Tabelle 1 dargestellt.
Opioid-induzierte Cheyne-Stokes-Atmung
Zentrale Apnoen wurden mittels PSG bei 17-24 % der Patienten festgestellt, die eine Langzeit-Opioidtherapie gegen chronische Schmerzen erhalten.21,22 In einer Reihe von klinischen Studien wurde gezeigt, dass eine ASV-Therapie die SDB bei Opioidkonsumenten verbessert. Das Ergebnis einer Meta-Analyse zeigte, dass die Behandlung mit ASV bei Patienten mit opioidbedingter CSA dazu führte, dass 58 % der Patienten einen CAI von 23 erreichten
Klinisch signifikante Reduzierungen des AHI, CAI und Hypopnoe-Index wurden nach nur einer Nacht der ASV-Anwendung bei Patienten beobachtet, die eine Langzeit-Opioidtherapie für nicht-maligne Schmerzen erhielten und die CSA hatten; Diese Verbesserungen blieben während einer 3-monatigen Heim-ASV-Therapie erhalten.24 Sowohl kurz- als auch langfristige Reduzierungen des AHI und des CAI während der ASV-Therapie wurden auch in einer anderen Studie zu opioid-assoziierter CSA dokumentiert, und die langfristige Adhärenz mit der ASV-Therapie in diesem Setting war gut (im Mittel 5,1 h/Nacht über einen Nachbeobachtungszeitraum von 9 Monaten bis 6 Jahren).25 Der Anteil der Responder scheint ebenfalls hoch zu sein, mit 59,6 %, die einen AHI von 26 erreichten. ASV hat möglicherweise auch die Fähigkeit, obstruktive Apnoen in diesem Setting zu verbessern.27
Vergleichende Daten zeigen, dass ASV bei chronischen Opioidkonsumenten wirksamer zur Reduzierung zentraler Apnoen ist als sowohl biPAP als auch CPAP. In einer kleinen Gruppe von chronischen Opioidempfängern, die während einer Nacht CPAP-Therapie keine Verbesserung der Schlafapnoe hatten, eliminierte die Anwendung von ASV für eine Nacht vollständig zentrale und obstruktive Apnoen und reduzierte den Hypopnoe-Index auf 13/h, verglichen mit einem AHI von 70/h bei Studienbeginn und 55/h während CPAP.28 In einer anderen Studie waren die AHI- und CAI-Werte signifikant
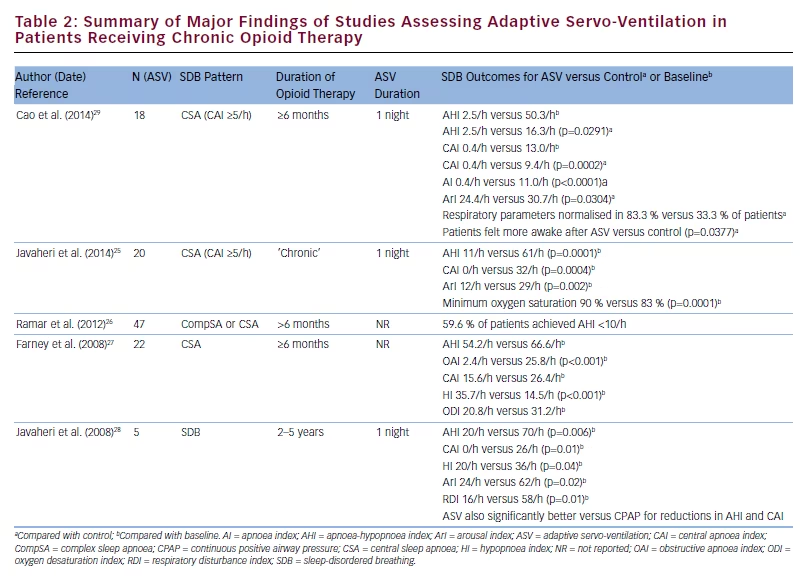
niedriger während der kurzzeitigen Anwendung von ASV im Vergleich zu biPAP mit Spontanzeitmodus (biPAP-ST) (2,5/h versus 16.3/h; p=0,0005 bzw. 0,4/h versus 9,4/h; p=0,0002).29 In dieser prospektiven Crossover-Studie betrug der Anteil der Patienten, die normalisierte Atmungsparameter aufwiesen, 83,3 % unter ASV und 33.3 % während der Bilevel-ST, und die Ergebnisse des Fragebogens zur Patientenzufriedenheit am Morgen danach zeigten, dass sich die Patienten nach der ASV-Behandlung wacher fühlten als nach der Bilevel-ST-Behandlung (p=0,0337).29 Die Ergebnisse der Studien, die den Einsatz von ASV bei Patienten mit Schlafapnoe unter Langzeit-Opioidtherapie untersuchten, sind in Tabelle 2 zusammengefasst.
Idiopathische Cheyne-Stokes-Atmung
In einigen Fällen wird trotz umfangreicher Untersuchungen keine offensichtliche Ursache für CSA-CSR gefunden und dies wird als idiopathische CSR bezeichnet, deren genaue Prävalenz unbekannt ist. Die Machbarkeit des Einsatzes von ASV zur Behandlung der idiopathischen CSR wurde bei drei Patienten untersucht, die nicht gut auf eine CPAP- und Sauerstofftherapie angesprochen hatten. Die ASV-Behandlung reduzierte den Index der abnormalen Ereignisse von 35,2/h auf 3,5/h, und auch die Anzahl der Arousals (18,5/h auf 1,1/h) wurde signifikant reduziert. Wichtig ist, dass die Nachbeobachtung nach 6-12 Monaten eine signifikante Verbesserung der Tagesaufmerksamkeit und der Stimmung bei den ASV-Empfängern zeigte.30
Schlafapnoe nach ischämischem Schlaganfall
SDB kann bei zwischen 50 % und 70 % der Patienten nach akutem ischämischem Schlaganfall31,32 dokumentiert werden und persistiert bei einem beträchtlichen Anteil der Patienten über die Akutphase hinaus.33 Die Rolle von ASV zur Behandlung von persistierendem CSA nach akutem ischämischem Schlaganfall wurde bei 15 Patienten untersucht, von denen 13 zuvor erfolglos mit CPAP oder biPAP behandelt worden waren.34 Der AHI betrug zu Beginn 46,7/h und sank nach 3 bzw. 6 Monaten ASV auf 8,5/h (p=0,001) und 10,7/h (p=0,024). ASV verbesserte auch die Tagesschläfrigkeit, mit einem Rückgang des ESS-Scores von 8,6 bei Studienbeginn auf 5,6 während ASV (p=0,08). Bei Patienten, die ASV für ≥5 h/Nacht verwendeten, sank der ESS-Score von 9,0 bei Studienbeginn auf 4,2 (p=0,028). Die ASV-Nutzung während der Studie war gut, mit einem Durchschnitt von 5 Stunden 20 Minuten pro Nacht nach 3 Monaten und 6 Stunden 22 Minuten pro Nacht nach 6 Monaten. ASV wurde auch gut vertragen und es wurden keine schweren Nebenwirkungen berichtet.
Wann sollte die Adaptive Servo-Ventilation nicht angewendet werden
Wie schon immer sollte ASV nicht in jeder Situation angewendet werden, in der eine Hypoventilation im Basalzustand vorliegt. Daher sollten die Blutgase wie bei jeder anderen Beatmungsstrategie vor Beginn der Behandlung überprüft werden. Darüber hinaus ist ASV aufgrund der Ergebnisse der SERVE-HF-Studie jetzt bei Patienten mit HFrEF (linksventrikuläre EF von 45 % oder weniger) und vorherrschender CSA kontraindiziert. Alle derzeitigen ASV-Empfänger, die diese Kriterien erfüllen, sollten über die SERVE-HF-Ergebnisse und deren Auswirkungen informiert werden und auf eine alternative Therapie umgestellt werden.
Therapieüberwachung
Es gibt derzeit keine veröffentlichten Leitlinien zur Patientenüberwachung und Nachsorge während der ASV-Therapie. Daher müssen Ärzte ihre klinische Praxiserfahrung und ihren gesunden Menschenverstand einsetzen. Vor Beginn der Behandlung erscheint es sinnvoll, auf HF-Symptome zu achten, die Krankengeschichte des Patienten sorgfältig zu überprüfen (mit besonderem Augenmerk auf kardiale Ereignisse) und im Zweifelsfall die linksventrikuläre EF mittels Echokardiographie zu bestimmen (insbesondere bei Patienten, die möglicherweise eine kardiovaskuläre Erkrankung haben). Die kurzfristige Nachbeobachtung sollte die Überprüfung auf Leckagen, Nebenwirkungen und Therapietreue beinhalten. Die Beurteilung der Behandlungseffektivität mit Polygraphie oder PSG nach 1-3 Monaten und eine 6-monatige Nachuntersuchung, bestehend aus einem klinischen Interview, einem Gerätedownload und einer vollständigen klinischen Beurteilung, erscheint sinnvoll. Eine fortlaufende echokardiographische Überwachung der EF scheint sinnvoll, wenn ASV bei Patienten mit kardialen Erkrankungen eingesetzt wird.
Perspektive und zukünftige Wege
Ein wichtiges Gebiet der laufenden Forschung ist die Aufklärung der pathophysiologischen Mechanismen, die dem kardiovaskulären Sicherheitssignal zugrunde liegen, das bei HFrEF-Patienten, die in der SERVE-HF-Studie mit ASV behandelt wurden, identifiziert wurde. Dies wird es ermöglichen, spezifische Untergruppen von HFrEF-Patienten zu identifizieren, bei denen ASV vermieden werden sollte, und andere, die von einer ASV-Therapie profitieren können. Daten aus der SERVE-HF-Hauptteilstudie5 und der On-Treatment-Analyse, der ADVENT-HF-Studie (NCT01128816) und laufenden Registern wie der französischen multizentrischen, prospektiven FACE-Kohortenstudie35 werden hoffentlich einen gewissen Einblick in den Einsatz von ASV in Untergruppen von HFrEF-Patienten mit CSA, Patienten mit HFrEF und OSA oder OSA mit koexistierender CSA und solchen mit HFpEF und beiden Formen von SDB geben. Die Auswirkungen von ASV bei Patienten mit akuter dekompensierter HF werden in der CAT-HF-Studie (NCT01953874) untersucht. Außerhalb der HF werden weitere Daten über den Einsatz von ASV bei Patienten mit verschiedenen CSA-Phänotypen benötigt, einschließlich behandlungsbedingter und opioidinduzierter zentraler Apnoen.
Schlussfolgerung
Es gibt eine Reihe unbeantworteter Fragen über den aktuellen und zukünftigen Stellenwert der ASV-Therapie bei Patienten mit verschiedenen Formen der SDB. Basierend auf den Ergebnissen der SERVE-HF-Studie sollte eine ASV-Therapie bei Patienten mit HFrEF und vorherrschender CSA mit CSR vermieden werden, und wenn ASV in anderen Indikationen eingesetzt wird, wird eine engmaschige Überwachung der Patienten empfohlen, insbesondere in Untergruppen mit dem Risiko, eine HF zu entwickeln. Die derzeit verfügbaren Daten deuten jedoch darauf hin, dass ASV bei Patienten mit behandlungsbedingter CSA, zentralen Apnoen im Zusammenhang mit einer Langzeit-Opioidtherapie ohne alveoläre Hypoventilation, idiopathischer CSR, nach ischämischem Schlaganfall und bei Patienten mit HFpEF vorteilhaft wirkt. Langfristige Daten über die Auswirkungen von ASV auf Morbidität und Mortalität in diesen Patientengruppen liegen noch nicht vor. Daher ist die Einleitung der Behandlung eine Entscheidung, die für jeden Patienten individuell getroffen werden sollte, und die Therapie sollte nur dann fortgesetzt werden, wenn der Patient während der Behandlung subjektive und objektive Verbesserungen zeigt.
ADVENT-HF = The Effect of Adaptive Servo-Ventilation on Survival and Hospital Admissions in Heart Failure
CAT-HF = Cardiovascular Improvements with MV ASV Therapy in Heart Failure
FACE = French Cohort Study of Chronic Heart Failure Patients with Central Sleep Apnoea Eligible for Adaptive Servo-Ventilation
SERVE-HF = Treatment of Sleep-Disordered Breathing with Predominant Central Sleep Apnea by Adaptive Servo-Ventilation in Patients with Heart Failure