1. Morphologie
2. Funktionen
Hepatozyten sind die Zellen der Leber und machen etwa 80 % dieses Organs aus. Sie sind in Blättern von etwa einer Zelldicke organisiert. Die Blätter sind untereinander verbunden und bilden eine schwammartige Struktur (Abbildungen 1 und 2). Hepatozyten sind relativ langlebige Zellen, die sich etwa alle 5 Monate erneuern. Dies kann sich jedoch bei regenerativen Prozessen ändern, bei denen Hepatozyten eine hohe Fähigkeit zur Proliferation und Regeneration von geschädigtem Lebergewebe zeigen.
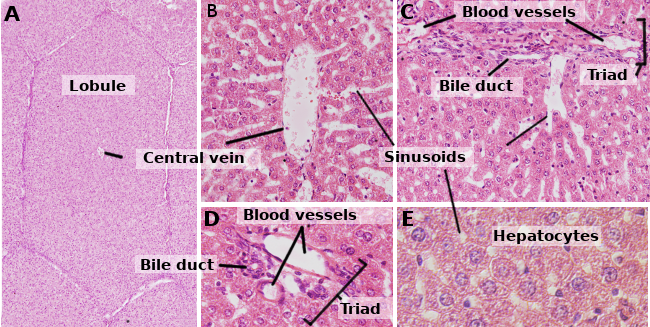

Morphologie
Hepatozyten sind polyedrale Zellen, das heißt, sie haben mehrere Gesichter. Normalerweise zeigen sie 6 Gesichter, aber die Anzahl kann variieren. Die Gesichter stehen entweder in Kontakt mit anderen Hepatozyten oder mit einem Sinusoid (Abbildung 3). Hepatozyten sind große Zellen, etwa 20 bis 30 µm im Durchmesser. Sie weisen einen runden, im Zytoplasma zentrierten Kern auf. In der Leber des erwachsenen Menschen können jedoch bis zu 25 % der Hepatozyten zweikernig sein (Abbildung 2). Die Mehrzahl der Kerne ist tetraploid, d. h. sie enthalten die doppelte Menge an DNA als eine normale Zelle. Die Größe der Kerne ist variabel, wobei sie bei tetraploiden Zellen größer sind. Kerne zeigen verstreutes Heterochromatin und einen oder mehrere Nukleoli. Es ist nicht üblich, mitotische Hepatozyten (1 auf 10000 oder 20000 Hepatozyten) unter normalen Bedingungen zu beobachten. Jedoch nehmen die mitotischen Hepatozyten unter Leberverletzungen und Regenerationsprozessen enorm zu. Die Beschaffenheit des Zytoplasmas variiert je nach physiologischem Zustand der Zelle, vor allem beeinflusst durch Fett- und Glykogendepots. Es gibt viele kleine Mitochondrien, 800 bis 100 pro Hepatozyt. Man schätzt, dass ein Hepatozyt etwa 50 Golgi-Apparate enthalten kann, die gewöhnlich in Stapeln von 3 bis 5 Zisternen organisiert sind, die verdickte seitliche Bereiche mit dunklen Körpern aufweisen. Die Zisternenstapel sind irgendwie im Zytoplasma verstreut, obwohl sie oft in der Nähe von Billiarkanälchen beobachtet werden (Abbildungen 3 und 4). Hepatozyten enthalten viele Peroxisomen (200 bis 300), mehr als andere normale Zellen. In der Nähe der billiären Canaliculi finden sich auch viele Lysosomen.


Im Zytoplasma der Hepatozyten finden sich reichlich Glykogen- und Lipiddepots (das körnige Aussehen der Hepatozyten nach Hämatoxylin- und Eosinfärbung ist auf die Löcher zurückzuführen, die durch die Lipidextraktion aus dem Zytoplasma während der Gewebeverarbeitung entstanden sind). Im Zytoplasma befinden sich außerdem Restkörperchen, die Lipofuszin enthalten. Das glatte endoplasmatische Retikulum ist recht reichlich vorhanden, obwohl die Größe der Organellen mit der Stoffwechselaktivität des Hepatozyten variiert. Es ist um die Glykogendepots herum konzentriert. In den Leberläppchen gibt es morphologische Unterschiede beim Vergleich von peripheren und zentralen Hepatozyten, die meist durch die Blutmerkmale beeinflusst werden. Zum Beispiel sind die peripheren Hepatozyten nach der Verdauung die ersten, die Glykogen speichern, aber die letzten, die dieses Glykogen bewegen, wenn der Rest des Körpers es benötigt. Die Fettspeicherung erfolgt jedoch zuerst in den zentral gelegenen Hepatozyten, die in der Regel ein glatteres endoplasmatisches Retikulum haben. Dagegen weist das raue endoplasmatische Retikulum in den peripher und mittel gelegenen Hepatozyten 50 % mehr Oberfläche auf als in denen im inneren Teil des Leberläppchens.
Im Gegensatz zu anderen Epithelzellen sind die Hepatozyten nicht an eine basale Membran gebunden. Ihre basolateralen Membranen sind von einer extrazellulären Matrix geringer Dichte umgeben, die von den Hepatozyten selbst synthetisiert wird. Sie erleichtert die Diffusion und den Austausch von Molekülen mit den Sinusoiden durch den Disse-Raum oder perisinousoidalen Raum, der der Raum zwischen dem fenestrierten Endothel und den Hepatozyten ist. Dieser extrazellulären Matrix fehlt Laminin, zumindest wenn der Hepatozyt differenziert ist. Typ-IV-Kollagen und Fibronektin sehen jedoch notwendig für eine korrekte Hepatozytendifferenzierung aus. Hepatozyten sind untereinander durch Gap Junctions, adhärente Junctions, Desmosomen und Tight Junctions verbunden.
Hepatozyten sind polarisierte Zellen, d.h. es gibt Unterschiede zwischen den Regionen, die den Gallenkanälchen zugewandt sind und den Regionen in der Nähe der Sinusoide. Die Polarität ist essentiell für die korrekte Funktion des Hepatozyten und ist bei vielen Leberpathologien desorganisiert. Der apikale Bereich steht in Kontakt mit den Gallenkanälchen (Canaliculi). Wie im apikalen Bereich der Epithelzellen gibt es Tight Junctions, die die Integrität der Gallenkanälchen abdichten und aufrechterhalten. Die apikale Membran ist in Mikrovilli gefaltet, die die Membranoberfläche enorm vergrößern. Die apikale Membran macht etwa 13 % der gesamten Hepatozytenmembran aus und ist in der Lage, eine große Menge an Molekülen aufzunehmen. Das Entfernen der Tight Junctions führt zur Desorganisation der Zellpolarität. Die Hepatozytenpolarität und die Gallenkanälchen werden während der Entwicklungszeit des Embryos etabliert.
Die funktionelle Polarität beruht auf einer ungleichen Verteilung von Transportern und anderen Membranmolekülen zwischen der apikalen und der baso-lateralen Plasmamembran-Domäne. ABC-Transporter (ATP-Bindungskassetten) gehören zu den wichtigsten apikalen Transportern in Hepatozyten. Der Golgi-Apparat, die Endosomen und das Zytoskelett (Mikrotubuli und Aktinfilamente) sind für die unterschiedliche Verteilung der Moleküle zwischen den beiden Membrandomänen verantwortlich. Es gibt zwei Lieferwege von Proteinen in die apikale Domäne (Abbildung 5): Vom Golgi-Apparat werden die Proteine (z. B. ABC-Transporter) in Vesikeln in Richtung apikale Plasmamembran oder in Richtung Recycling-Endosomen, die als Intermediäre fungieren, freigesetzt. Andere Proteine folgen einem Transzytose-Weg, indem sie zunächst zu basolateralen Membranen wandern und dann in Endozytose-Vesikeln in Richtung Endosomen eingeschlossen werden, wo sie wiederum in Vesikel verpackt und zur apikalen Membran transportiert werden. Seltener ist ein Weg, der die Exozytose von Lysosomen einschließt, gefolgt von Cooper-Transportern.

Funktionen
Die Hauptfunktion der Hepatozyten ist die Verstoffwechselung von Substanzen aus der Verdauung. Die Leber wird von der Pfortader durchflossen, die Moleküle aus der Verdauung im Darm sammelt. Hepatozyten sind auch stark an der Entgiftung von potentiell schädlichen Molekülen beteiligt. Andererseits synthetisieren die Hepatozyten die Galle, die schließlich in den Darm abgegeben wird und bei der Verdauung hilft. Für beide Funktionen, die Verstoffwechselung von Molekülen aus der Verdauung und die Freisetzung von Galle, befinden sich die Hepatozyten an einem privilegierten Ort: in Kontakt mit den Sinusoiden, die verdaute Moleküle in den Darm bringen, und bilden die Gallenkanälchen, die die Galle aus den Leberläppchen ableiten.
Glukosespiegel. Hepatozyten holen Glukosemoleküle aus der Verdauung ab und speichern sie als Glykogen, das mobilisiert wird, wenn der Körper Energie benötigt. Glykogen findet sich häufig in der Nähe des endoplasmatischen Retikulums, da sich in dieser Organelle das Enzym Glucose-6-Phosphatase befindet. Glukose-6-Phosphatase katalysiert Glukose-6-Phosphat, die molekulare Form der Glukose nach dem Glykogenabbau, und produziert freie Glukose, die den Hepatozyten verlassen und in den Blutkreislauf gelangen kann.
Molekülsynthese. Gallensalze, die bei der Fettverdauung helfen, sind eine der Substanzen, die von den Hepatozyten synthetisiert werden. Im glatten endoplasmatischen Retikulum befinden sich viele Enzyme, die an der Synthese von Cholesterin und anderen Lipiden beteiligt sind. Darüber hinaus produzieren die Hepatozyten Lipoproteine, die für den Transport der Lipide im Blutkreislauf benötigt werden. Fibrinogen für die Blutgerinnung und Plasmaalbumine werden ebenfalls von Hepatozyten synthetisiert. In der Leber wird Harnstoff als Nebenprodukt des Proteinabbaus produziert. Die Produktion und Anhäufung einer hohen Menge an Harnstoff im Organismus kann schädlich sein. Hepatozyten speichern Vitamin A und B sowie Heparin.
Lipidstoffwechsel. In den reichlich vorhandenen Peroxisomen der Hepatozyten findet die Beta-Oxidation statt, die am Lipidkatabolismus beteiligt ist.
Entgiftung. Hepatozyten sammeln nahrhafte Substanzen aus der Verdauung, aber sie sind auch die ersten, die potentiell toxische Substanzen aufnehmen. Ethanol aus alkoholischen Getränken wird hauptsächlich in der Leber abgebaut, und zwar in den vielen Peroxisomen der Hepatozyten. In diesen Organellen wird die Hälfte des aufgenommenen Alkohols in Acetaldehyd umgewandelt. Im glatten endoplasmatischen Retikulum befinden sich Enzyme, die am Abbau oder der Inaktivierung von Toxinen und Medikamenten beteiligt sind. In Zeiten, in denen ein hoher Bedarf an der Beseitigung von toxischen Substanzen besteht, wie z.B. bei Medikamentenbehandlungen oder kontinuierlichem Alkoholkonsum, kann das endoplasmatische Retikulum zur voluminösesten Organelle des Hepatozyten werden. Medikamente werden normalerweise durch Konjugation mit anderen Molekülen inaktiviert. Zum Beispiel konjugiert die Glucosyltransferase Moleküle mit Barbituraten.
Speicherung und Regulierung von Eisen. Hepatozyten können für die Speicherung von Eisen arbeiten, das in zytoplasmatischen Depots an Ferritin gebunden konzentriert ist. Hepatozyten können Eisen auf verschiedene Weise aufnehmen: gebunden an Transferrin, als Teil von Häm-Gruppen und aus Nicht-Häm-Gruppen. Transferrin-Eisen gelangt durch TRF1-Rezeptor-vermittelte Endozytose in die Zelle. Wenn endozytische Vesikel mit Endosomen fusionieren, setzt Transferrin Fe3+ frei, das in F2+ umgewandelt und durch den DMT1 (divalent metal transporter 1)-Transporter in das Zytosol extrudiert wird. Häm-Eisen-Moleküle werden ebenfalls endozytiert und durch den HRG1-Transporter durch die endosomale Membran in das Zytosol transloziert. Der Großteil des Eisens gelangt jedoch aus dem Extrazellulärraum durch den ZIP14-Transporter, der sich in der Plasmamembran der Hepatozyten gegenüber den Sinusoiden befindet. Einmal im Zytosol angekommen, wird das Eisen an Ferritin gebunden und im Zytoplasma gespeichert, da das freie Eisen toxisch ist. Die Freisetzung des Eisens aus dem Enterozyten wird durch den Ferroportin-Transporter vermittelt, der sich in der Plasmamembran nahe der Sinusoide befindet.
Nach dem Knochenmark ist die Leber das zweite große Produktionszentrum von Häm-Gruppen. Die Häm-Gruppe ist eine prosthetische Gruppe (nicht peptidisch), die in mehreren Proteinen für den Sauerstofftransport, in den Enzymen wie Katalasen und Peroxidasen, die vor oxidierenden Substanzen schützen, vorhanden ist. Sie ist auch Bestandteil der mitochondrialen und peroxysomalen Cytochrome. Die größere Menge an Häm-Gruppen findet sich im Hämoglobin, das im Knochenmark synthetisiert wird. In der Leber hängt die Hämgruppen-Synthese von der Menge der mikrosomalen p450-Cytochrome ab, die die Zelle benötigt, so dass die meisten dieser Hämgruppen Teil der p450-Cytochrome sind.
Die Hepatozyten setzen das Hormon Hepcidin frei, das die systemische Eisenkonzentration im Körper reguliert. Dieses Hormon kontrolliert die Eisenmenge im Plasma, indem es die Internalisierung und den Abbau von Ferroportin begünstigt, einem Eisentransporter, der in Enterozyten, Makrophagen und Hapatozyten vorkommt. Die Entfernung von Ferroportin hemmt die Freisetzung von Eisen aus diesen Zellen. Die Hepcidin-Synthese wird durch die Transferrin-Eisen-Konzentration im Plasma, durch Eisendepots in den Hepatozyten und durch Entzündungen reguliert. Die erythropoetische Aktivität hemmt die Freisetzung von Hepcidin.
Bibliographie
Gissen P, Arias IM. 2015. Strukturelle und funktionelle Hepatozytenpolarität und Lebererkrankungen. Journal of hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Adulte intestinale Stammzellen: kritische Treiber der epithelialen Homöostase und Regeneration. Nature Review in Molecular Cell Biology. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelona.