Erstmals 1961 entdeckt und bis in die 70er Jahre hinein wurde Amiodaron wegen seiner antiarrhythmischen Eigenschaften verwendet, wenn auch nicht offiziell vor dem Jahr 1985, als die Vereinigten Staaten schließlich seine Verwendung genehmigten. Die Food and Drug Administration (FDA) hatte gezögert, das Medikament zuzulassen, da anfängliche Berichte eine erhöhte Inzidenz von unerwünschten pulmonalen Wirkungen zeigten. Europäische Pharmafirmen begannen Mitte der 80er Jahre mit der Institution zu diskutieren und drohten damit, ihre (kostenlose) Belieferung amerikanischer Ärzte mit dem Medikament einzustellen, sollte die FDA keine offizielle Zulassung erteilen. Die Zulassung wurde schließlich im Dezember 1985 erteilt. Damit ist es eines der wenigen Medikamente, die von der FDA ohne vorherige randomisierte klinische Studien zugelassen wurden.
I – Wirkmechanismus und pharmakologische Effekte
Die zwei Jod-Atome, die im Amiodaron-Molekül, einem Benzofuran-Derivat, enthalten sind, sind wesentlich für seine antiarrhythmischen Eigenschaften. Nach der Vaughan-Williams-Klassifikation der Antiarrhythmika verlängert Amiodaron das Aktionspotential der Phase 3 der Herzzellen und weist auch alle elektrophysiologischen Eigenschaften der Klasse 4 auf.
Die Absorption ist extrem langsam, und auch die Bioverfügbarkeit ist gering und variabel. Die Latenzzeit zwischen Verabreichung und Wirkung kann jedoch durch eine hohe orale oder intravenöse Dosierung verkürzt werden.
Andererseits bindet das Medikament vollständig an Plasmaproteine und hat ein großes Verteilungsvolumen. Es wird dann in der Leber metabolisiert. Die Clearance ist ebenfalls gering mit einer geschätzten Eliminationshalbwertszeit von 30-180 Tagen, was auf seinen Metaboliten, das Desethylamiodaron, zurückzuführen ist, das die Anreicherung des Medikaments in peripheren Geweben bewirkt, die aufgrund ihrer Affinität zu intralisosomalen Phospholipiden als Reservoir fungieren. Diese Einschlusskörper wurden in der Lunge, der Leber, dem Herz, der Haut, dem Hornhautepithel und den peripheren Nerven gefunden, was seine toxischen Wirkungen in vielen Organen und die proportionale Beziehung zwischen Toxizität, Anwendungsdauer und kumulativer Dosis erklärt.
Eine tägliche Standard-Erhaltungsdosis von 200 mg Amiodaron setzt 75 mg organisches Jod frei. Es ist wichtig zu betonen, dass der normale Tagesbedarf an Jod bei 0,2 bis 0,8 mg liegt – mehr als 100-mal niedriger als das, was mit Amiodaron abgegeben wird.
Niedrig dosiertes Amiodaron (100-300 mg pro Tag) ist wirksam bei einer Vielzahl von ventrikulären und supraventrikulären Arrhythmien, auch als Teil einer Rhythmuskontrollstrategie für Patienten mit Vorhofflimmern, insbesondere wenn eine strukturelle Herzerkrankung vorliegt. Wenn andere Medikamente versagt haben, Arrhythmien zu kontrollieren, sind hohe Dosen von Amiodaron erforderlich und führen zu einem Anstieg der Inzidenz von schwerwiegenden unerwünschten Nebenwirkungen.
II – Auswirkungen der Amiodaron-Therapie auf das Überleben in der klinischen Praxis
Eine Reihe von Nebenwirkungen wurde im Laufe der Zeit beschrieben, insbesondere bei chronischer Anwendung. Es wird geschätzt, dass die Prävalenz von unerwünschten Wirkungen im Zusammenhang mit der Behandlung mit Amiodaron bei 15 % im ersten Jahr und bei 50 % bei längerer Anwendung liegt. Darüber hinaus ist bei 20 % der Patienten ein Abbruch der Therapie aufgrund von Effekten wie Leberschäden, Problemen mit der Schilddrüsenfunktion und chronischer Lungenentzündung erforderlich, die bei bis zu 1 % pro Behandlungsjahr beschrieben wurden, wobei die kumulativen Schäden zwischen 5 und 10 % liegen. Am bekanntesten sind Lungenschäden, die nach langer Exposition mit Amiodaron auftreten (2.3), aber es gibt auch Berichte über akute Toxizität.
Hier sind die häufigsten, kollateralen Wirkungen des Medikaments:
a) Lunge
Die Amiodaron-induzierte pulmonale Toxizität (APT) ist eine der schwerwiegendsten Nebenwirkungen bei der Anwendung. Die Inzidenz liegt bei etwa 5 %, wenn Dosen von 400 mg oder mehr täglich verwendet werden.
Interessanterweise fand die Vorhofflimmern-Follow-up-Untersuchung der Rhythmusmanagement-Studie (AFFIRM) eine erhöhte Inzidenz der pulmonalen Toxizität bei Patienten mit vorbestehenden Lungenerkrankungen. Die Sterblichkeit aufgrund pulmonaler Ursachen und die Gesamtsterblichkeit waren bei diesen Patienten jedoch nicht höher als bei Patienten ohne vorbestehende Lungenerkrankung.
Der Wirkmechanismus dieser Pathologie kann direkt durch die Freisetzung freier Radikale oder indirekt durch eine Überempfindlichkeit des Patienten sein. Die Risikofaktoren, die mit dieser unerwünschten Wirkung in Verbindung gebracht werden, sind nicht gut identifiziert worden, stehen aber möglicherweise im Zusammenhang mit kumulativen Dosen, Tagesdosen über 400 mg, fortgeschrittenem Alter und zugrundeliegender Lungenerkrankung.
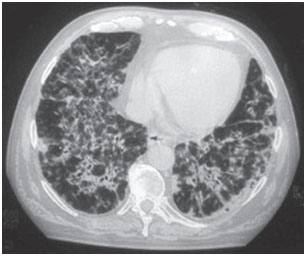
Amiodaron-Pulmonaltoxizität kann sich auf verschiedene Weise präsentieren: interstitielle Lungenentzündung, Atemnot oder solitäre pulmonale Massen. Die klinischen Szenarien sind variabel, die häufigsten Symptome sind Dyspnoe und trockener Husten, aber die Symptome können auch Fieber, Gewichtsverlust, Hämoptysen und Brustschmerzen, die durch Atembewegungen verstärkt werden, umfassen. Röntgenaufnahmen des Brustkorbs zeigen unregelmäßige oder ungleichmäßige bilaterale interstitielle Infiltratveränderungen (Abbildungen 1 und 2). Atemfunktionstests zeigen ein restriktives Muster mit verminderter und diffuser Gesamt-Lungenkapazität. Der Mechanismus der Lungentoxizität ist nicht geklärt, scheint aber ebenfalls dosisabhängig zu sein.
Die Diagnose der APT wird durch die unspezifischen Symptome, klinischen Befunde und Ergebnisse von Bildgebungs- und Labortests erschwert, so dass sie als Ausschlussdiagnose gilt. Die Differentialdiagnose sollte mit Herzinsuffizienz, Lungenentzündung, Lungenembolie und neoplastischen Erkrankungen durchgeführt werden. Die Prognose ist günstig, mit einer niedrigen Sterblichkeitsrate, außer bei Patienten, die Atemnot entwickeln, deren Sterblichkeit sich 50 % nähert. (3)
Die Behandlung basiert auf dem Absetzen des Medikaments und der Verabreichung von Kortikosteroiden, die trotz eines anfänglich verbesserten Patientenzustands über mehrere Monate fortgesetzt werden sollte, da die lange Halbwertszeit von Amiodaron zu einer erneuten Verschlimmerung der Symptome führen kann. Zur Vorbeugung und Früherkennung dieser möglichen Komplikation ist eine Röntgenaufnahme des Brustkorbs zu Beginn und danach jährlich erforderlich.
b) Schilddrüse
Klinische Hinweise auf eine Schilddrüsenunterfunktion treten bei bis zu 20 % der Patienten unter Amiodaron auf. Amiodaron verhindert die periphere Umwandlung von T4 in T3 und verändert die Schilddrüsenfunktionstests. Die großen Mengen an Jod, die in Amiodaron enthalten sind, können diese Effekte erklären.
Die Hypothyreose lässt sich leicht mit Levothyroxin behandeln und ist im Allgemeinen kein Grund für das Absetzen von Amiodaron. Hyperthyreose tritt bei 3 % der Patienten in Jodmangelgebieten auf, aber bei 20 % in Gebieten mit ausreichender Jodversorgung. Sie kann schwer zu erkennen sein, weil viele der typischen adrenergisch vermittelten Zeichen durch Amiodaron blockiert werden.
Bei Patienten, die Amiodaron einnehmen, zeigt sich im ersten Monat der Behandlung ein Anstieg von T4 (20-40 %), reversem T3 (20 %) und TSH sowie ein Abfall von T3, der sich nach drei Monaten wieder normalisiert.
In einigen Fällen erforderte das Wiederauftreten von Vorhofflimmern bei Patienten mit Amiodaron-Erhaltungstherapie eine sofortige Untersuchung, um eine Amiodaron-induzierte Hyperthyreose auszuschließen.
Das erhöhte Risiko tritt bei Patienten mit abnormaler Ausgangsfunktion der Schilddrüse (Autoimmunerkrankung, Struma) und bei älteren Menschen auf. Frauen mit positiven antithyreoten Antikörpern haben ein siebenfach erhöhtes Risiko für diese Komplikation.
Wir empfehlen eine Analyse von TSH, T4 und T3 zu Beginn der Behandlung, einen Monat nach Behandlungsbeginn und danach alle sechs Monate.
Die Diagnose wird vermutet, wenn erhöhte TSH-Werte und erniedrigte T4- und T3-Werte vorliegen. Wir möchten unsere Leser daran erinnern, dass der TSH-Anstieg in den ersten drei Monaten nach Beginn der Behandlung mit Amiodaron an sich kein Problem darstellt, da es sich um ein vorübergehendes Phänomen handeln kann – die Behandlung mit Amiodaron kann fortgesetzt werden, sofern Levothyroxin hinzugefügt wird. Auch Trijodthyronin kann zeitweise zugesetzt werden, wenn die TSH-Werte nicht ausreichend gesunken sind. Das Management erfordert dann die Unterstützung eines erfahrenen Endokrinologen und das Absetzen der Amiodaron-Therapie.
Bei allen Patienten sollten die Thyreotropin-Werte vor Beginn der Amiodaron-Therapie und danach alle Monate kontrolliert werden.
c) Andere Bereiche – gastrointestinal, Leber, Herz, Augen, Haut
Gastrointestinale Störungen wie Übelkeit, Erbrechen, Durchfall oder Anorexie sind zu Beginn der Behandlung häufig (30 %). Einige der am meisten gefürchteten gastrointestinalen Nebenwirkungen – Hepatitis und Leberzirrhose – sind jedoch selten (<3%). Es wird empfohlen, die Leberfunktion zu Beginn der Behandlung und dann alle sechs Monate zu testen. Zu Beginn der Behandlung wird im Allgemeinen ein Anstieg der Leberenzyme beobachtet; ein Absetzen der Behandlung wird nicht empfohlen, es sei denn, die Werte übersteigen das Zwei- oder Dreifache des Normalwerts. Dieser Anstieg ist nach Ansicht einiger Autoren kein Hinweis darauf, dass das Medikament abgesetzt werden muss: Dennoch wird eine engmaschige Überwachung empfohlen.
Kardiale unerwünschte Wirkungen einschließlich Bradykardie wurden bei 5 % der Patienten und polymorphe ventrikuläre Arrhythmien (Torsade de pointes) bei 1 % bis 2 % der Patienten, insbesondere bei Patienten mit Risikofaktoren dafür, berichtet. Daher sollte ein EKG zu Beginn der Behandlung und dann jährlich durchgeführt werden. Bei Patienten mit einem Kardioverter-Defibrillator (ICD) kann Amiodaron die Zykluslänge ventrikulärer Tachykardien erhöhen, was dazu führen kann, dass diese erkannt werden und die Wirksamkeit des Geräts beeinträchtigen können (4).
Schließlich treten neben anderen geringfügigen unerwünschten Wirkungen bei fast 100 % der Patienten, die dieses Medikament länger als sechs Monate erhalten, Mikroablagerungen auf der Hornhaut auf. Ihr Vorhandensein erfordert keinen Abbruch der Behandlung, da sie nicht mit einer Beeinträchtigung der Sehschärfe verbunden sind. Augenreaktionen, wie z. B. Sehnervenentzündung, Atrophie mit Sehverlust oder beides, sind schwerwiegender, aber sie sind selten und es gibt keine nachgewiesene Kausalität von Amiodaron in Bezug auf diese. Eine augenärztliche Beurteilung ist nur bei einem Sehdefizit angezeigt.
Andere berichtete Nebenwirkungen sind Lichtempfindlichkeit und blaue Hautpigmentierung, die nach Absetzen der Behandlung verschwinden. Bei unserem Patienten wurde nach Durchführung verschiedener Tests und dem Verdacht, dass das klinische Bild der Patientin einer TPA entsprach, Amiodaron abgesetzt und eine Kortikosteroidtherapie eingeleitet (40-60 mg Tagesdosis über sechs Monate hinweg). Mit dieser Behandlung erfuhr der Patient eine zufriedenstellende klinische und radiologische Erholung.
Schließlich kann Amiodaron bei etwa 15 % der Patienten, die es intravenös erhalten, eine Hypotonie verursachen. Die Hypotonie kann zunächst durch eine Verringerung der Infusionsrate behandelt werden.
Abbildung 1A. Posteroanteriore Röntgenbilder des Brustkorbs, aufgenommen zum Zeitpunkt der klinischen Präsentation und nach drei Monaten der Behandlung. Amiodaron infiltriert alveolointerstitielle bilaterale basale Lungenfelder; die Medien sind jedoch bei der Nachuntersuchung verschwunden (Bild weiter unten).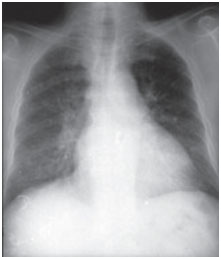
Abbildung 1B. Computertomographie des Brustkorbs – bei demselben Patienten, bilaterale und diffus alveolär-interstitiell infiltrierte Probe mit Luftbronchialbereichen.