Einführung in Säureanhydride
Diese Seite erklärt, was Säureanhydride sind und betrachtet ihre einfachen physikalischen Eigenschaften wie Siedepunkte. Sie stellt ihre chemische Reaktivität in allgemeiner Weise vor, aber Details zu spezifischen Reaktionen werden auf separaten Seiten gegeben – siehe das Menü Säureanhydride (Link am Ende der Seite).
Was sind Säureanhydride?
Die Struktur von Säureanhydriden
Eine Carbonsäure wie die Ethansäure hat die Struktur:
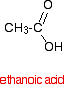
Wenn man zwei Ethansäuremoleküle nimmt und ein Molekül Wasser dazwischen entfernt, erhält man das Säureanhydrid, Ethansäureanhydrid (alter Name: Essigsäureanhydrid).
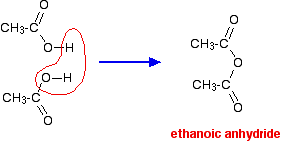
Man kann Ethansäureanhydrid tatsächlich durch Dehydratisierung von Ethansäure herstellen, aber es wird normalerweise auf einem effizienteren, umständlicheren Weg hergestellt. (Die Herstellung von Ethansäureanhydrid sprengt den Rahmen des UK A Levels.)
Benennung von Säureanhydriden
Das ist wirklich einfach. Man nimmt einfach den Namen der Muttersäure und ersetzt das Wort „Säure“ durch „Anhydrid“. „Anhydrid“ bedeutet einfach „ohne Wasser“.
So … Ethansäure bildet Ethansäureanhydrid; Propansäure bildet Propansäureanhydrid, und so weiter.
Für die Zwecke des UK A-Levels ist das einzige, mit dem man überhaupt zu tun haben wird, Ethansäureanhydrid.
Physikalische Eigenschaften von Säureanhydriden
Wir werden Ethansäureanhydrid als typisch nehmen.
Erscheinungsbild
Ethansäureanhydrid ist eine farblose Flüssigkeit, die stark nach Essig (Ethansäure) riecht.
Der Geruch kommt daher, dass Ethansäureanhydrid mit dem Wasserdampf in der Luft (und der Feuchtigkeit in der Nase) reagiert und wieder Ethansäure bildet. Diese Reaktion mit Wasser wird auf einer anderen Seite ausführlich beschrieben. (Sie finden sie im Menü Säureanhydride – Link am Ende dieser Seite.)
Löslichkeit in Wasser
Ethansäureanhydrid kann nicht als wasserlöslich bezeichnet werden, da es mit Wasser zu Ethansäure reagiert. Eine wässrige Lösung von Ethansäureanhydrid gibt es nicht.
Siedepunkt
Ethansäureanhydrid siedet bei 140°C. Das liegt daran, dass es ein ziemlich großes polares Molekül ist und daher sowohl van-der-Waals-Dispersionskräfte als auch Dipol-Dipol-Attraktionen hat.
Es bildet jedoch keine Wasserstoffbrückenbindungen. Das bedeutet, dass ihr Siedepunkt nicht so hoch ist wie der einer Carbonsäure ähnlicher Größe. Die Pentansäure (die ähnlichste Säure) siedet zum Beispiel bei 186 °C.