A.M.C. Davies
Norwich Near Infrared Consultancy, 10 Aspen Way, Cringleford, Norwich NR4 6UA, UK
Wenn Sie Ihre Hand an ein brennendes Feuer halten, „fühlen“ Sie die Wärme, die das Feuer abgibt, aber was passiert da? Das Feuer gibt Licht und Infrarot (IR)-Strahlung ab; bei einem Feuer ist das meiste davon Nah-Infrarot (NIR)-Strahlung. Ein Teil der NIR-Strahlung wird von den Wassermolekülen in Ihrer Haut absorbiert. Dadurch erhöht sich die Temperatur des Wassers und führt zu einem Temperaturanstieg im umgebenden Gewebe, der von den Nerven in Ihrer Haut wahrgenommen wird. Diese Strahlung wurde im Jahr 1800 von William Herschel, einem Musiker und sehr erfolgreichen Amateurastronomen (er entdeckte den Planeten Uranus), entdeckt, weil er wissen wollte, ob eine bestimmte Farbe mit der Wärme des Sonnenlichts verbunden ist. Er fand heraus, dass das Wärmemaximum jenseits des roten Endes des Spektrums lag. Herschel konnte nicht glauben, dass Licht und seine „Strahlungswärme“ zusammenhängen, aber er irrte sich. Bis 1835 hatte Ampere gezeigt, dass der einzige Unterschied zwischen Licht und dem, was er „Infrarotstrahlung“ nannte, ihre Wellenlänge war. Dann im Jahr 1864 schrieb James Maxwell „Diese Geschwindigkeit ist so nah an der des Lichts, dass es scheint, wir haben starken Grund zu dem Schluss, dass Licht selbst (einschließlich strahlende Wärme und andere Strahlungen) ist eine elektromagnetische Störung in Form von Wellen durch das elektromagnetische Feld nach elektromagnetischen Gesetzen propagiert“. Was wir heute das elektromagnetische Spektrum nennen, ist in Abbildung 1 dargestellt.

Frühgeschichte der Untersuchung von Infrarot-Absorptionen
Die ersten (nahen) Infrarotspektren wurden 1881 von Abney und Festing mit Hilfe von fotografischen Platten gemessen. Sie erzeugten nicht nur die ersten Spektren, sondern vermuteten auch zu Recht, dass die Absorptionen mit der chemischen Zusammensetzung der von ihnen untersuchten Flüssigkeiten zusammenhingen. Der wichtigste Pionier der IR-Spektroskopie war William W. Coblentz. Im Jahr 1905 veröffentlichte er das Ergebnis einer großen Studie von Verbindungen, deren Spektren er von 1000 nm bis 16.000 nm aufgezeichnet hatte. Coblentz‘ Arbeit war insofern ein Durchbruch, als die Forscher in der Lage waren, den Charakter von Atomgruppen innerhalb von Molekülen mit spezifischen Absorptionen im mittleren IR-Bereich (2500-50.000 nm) in Verbindung zu bringen. Diese Absorptionen sind das Ergebnis von Wechselwirkungen mit den Grundschwingungen der chemischen Bindungen, die mit den Atomen der Gruppen verbunden sind. Wir können uns chemische Bindungen als schwache Federn vorstellen, die zwei oder mehr Atome zusammenhalten. Diese Federn schwingen natürlich und wenn dem System Energie zugeführt wird, dann schwingen sie energetisch stärker. Allerdings sind die Atome in Molekülen durch die Quantenmechanik eingeschränkt, so dass nur einige bestimmte Energieniveaus erlaubt sind. Wenn wir nur zwei Atome haben, dann wird die einzige Schwingung als Streckung gesehen. Wenn drei oder mehr Atome beteiligt sind, können sich die Bindungen auch biegen, was zu einer ganzen Reihe verschiedener Schwingungen führt. Streckschwingungen benötigen mehr Energie als Biegeschwingungen, aber auch die Energieanforderungen der Biegeschwingungen variieren. Verschiedene chemische Bindungen (wie O-H, C-H und N-H) variieren in ihrer Stärke und damit in der Menge an Energie, die für die Bindungsschwingung erforderlich ist, um sich von einer Ebene zur nächsten zu bewegen. Diese Variation in der Energie wird in einem Spektrum als eine Reihe von Absorptionen bei verschiedenen Wellenlängen gesehen. Durch die Betrachtung des Spektrums können wir ableiten, welche Schwingungen auftreten und somit die Struktur des Moleküls (oder der vorhandenen Atomgruppen) herausarbeiten.
Eine der sehr nützlichen Eigenschaften der mittleren IR-Spektren ist, dass der Bereich von 8500 nm bis 12.500 nm sehr charakteristisch für das gemessene Molekül ist und dieser Bereich als „Fingerabdruck“-Bereich bekannt ist, weil er zur Bestätigung der Identität vieler reiner Substanzen verwendet werden kann. Während das Studium der mittleren IR-Spektroskopie vor allem nach dem Zweiten Weltkrieg weiter zunahm, erstreckte sich das Interesse am NIR auf quantitative Messungen von Wasser, einigen wenigen einfachen organischen Verbindungen und einigen wenigen Untersuchungen von spezifischen Proteinen. Niemand betrachtete es als nützlich für die Charakterisierung von Proben und es wurde als zu komplex für den Einsatz in der quantitativen Analyse angesehen.
Absorptionen im NIR-Bereich
Wenn sich chemische Bindungen genau wie schwache Federn verhalten würden, dann würde die Quantenmechanik ihre Schwingung auf nur zwei Zustände beschränken und es gäbe sehr wenige Absorptionen im NIR-Bereich. Absorptionen im NIR-Bereich (780-2500 nm) werden aus Grundschwingungen durch zwei Prozesse erzeugt: Obertöne und Kombinationen. Obertöne kann man sich als Oberschwingungen vorstellen. So erzeugt jeder Grundton eine Reihe von Absorptionen bei (annähernd ganzzahligen) Vielfachen der Frequenz (Frequenz ist der Kehrwert der Wellenlänge). Kombinationen sind etwas komplexer. NIR-Absorptionen befinden sich in einem höheren Erregungszustand, so dass sie mehr Energie benötigen als eine Grundtonabsorption. Kombinationen entstehen durch die Aufteilung der NIR-Energie zwischen zwei oder mehreren Grundtonabsorptionen. Während die Anzahl der möglichen Obertöne aus einer Gruppe von fundamentalen Absorptionen in einem Molekül auf einige wenige beschränkt ist, wird eine sehr große Anzahl von Kombinationen beobachtet. Die Wirkung all dieser Absorptionen führt dazu, dass viele NIR-Spektren eher uninteressant aussehen und nur aus wenigen, recht breiten Peaks bestehen. Abbildung 2 ist ein NIR-Spektrum von Chloroform, CHCl3, das Molekül enthält nur ein Wasserstoffatom, aber alle Absorptionen in seinem Spektrum werden durch dieses einzelne Atom verursacht.
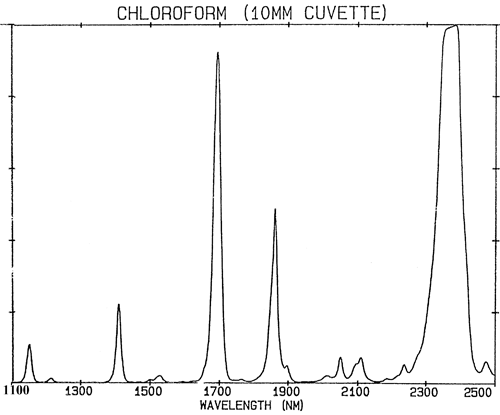
Es ist eine wichtige Verallgemeinerung, dass die NIR-Spektroskopie von Wasserstoff dominiert wird. Abbildung 3 ist ein Spektrum von Methanol, CH3OH, das vier Wasserstoffatome enthält (aber drei sind äquivalent) und dieses Spektrum ist viel mehr wie ein typisches NIR-Spektrum mit breiten Peaks. Abbildung 4 ist ein Spektrum von Saccharose, C12H24O12, das sehr breite Absorptionsbereiche, aber auch einige recht schmale Peaks zeigt. Es ist wichtig zu erkennen, dass alle diese breiten Absorptionen durch mehrere schmale, überlappende Absorptionen verursacht werden. NIR-Spektren sind viel komplexer als sie erscheinen.
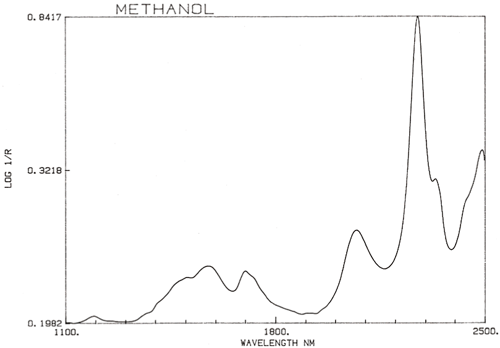
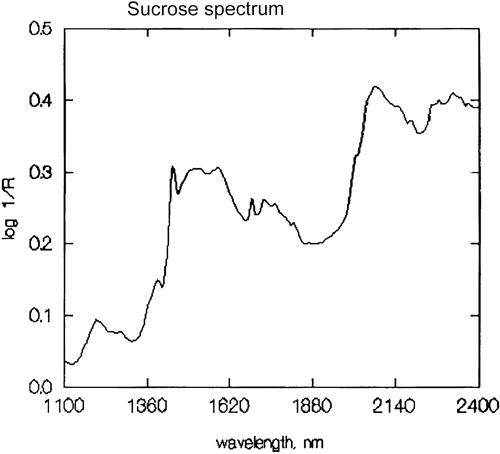
Obwohl NIR-Spektren komplizierter sind, ist es möglich, einige allgemeine Beobachtungen zu machen. Da eine fundamentale O-H-Streckungsabsorption sich von einer fundamentalen C-H-Streckung unterscheidet, wird auch die Reihe der Obertöne, die von diesen Absorptionen erzeugt werden, unterschiedlich sein. Das Gleiche gilt für Kombinationsbanden. Die häufigsten (und energiereichsten) Kombinationsbanden entstehen durch Kombinationen von Streckung und Biegung in derselben Gruppe. Wir sehen also Absorptionen aufgrund der Kombination von O-H-Streckung mit O-H-Biegung und C-H-Streckung mit C-H-Biegung, und diese treten an verschiedenen Positionen im Spektrum auf. Abbildung 5 ist das NIR-Spektrum einer Probe von Keksteig. Keksteig enthält mehrere Zutaten, von denen jede viele verschiedene Moleküle enthält, so dass dieses Spektrum Hunderte, wenn nicht Tausende von Absorptionen enthält, aber wir sehen die Integration von ihnen allen und es scheint nur ein paar breite Absorptionen zu geben. Anhand ihrer Position können wir allgemein die Ursache der Absorption bestimmen, wie in der Abbildung dargestellt.
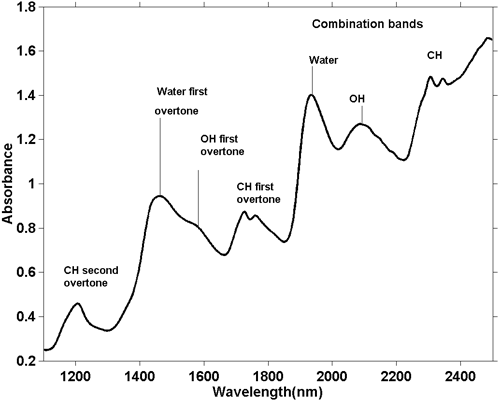
Als die Komplexität der NIR-Absorption zum ersten Mal erkannt und mit den relativ leichter zu verstehenden mittleren IR-Spektren verglichen wurde, dachten die meisten Forscher, dass mit dem Studium der NIR-Spektroskopie wenig zu gewinnen sei. Der Bereich wurde vernachlässigt und den Studenten wurde fälschlicherweise beigebracht, dass man mit dem Studium des NIR-Bereichs nichts gewinnen kann. Vielen Studenten wird immer noch die gleiche Meinung beigebracht. Die Voraussetzungen waren: sehr rauscharme Spektrometer, der elektronische Computer, die Anwendung mathematischer Techniken (Chemometrie) und ein Genie, das alles zusammenbrachte. Dieser Mann war Karl Norris; ein Ingenieur, der für das USDA in Beltsville arbeitete. Er hatte keinen Unterricht in Spektroskopie erhalten und wusste daher nicht, dass es im NIR-Bereich nichts zu gewinnen gab. Ähnlich wie Herschel, der nach etwas suchte, wo nichts war, entwickelte Norris die Instrumente und setzte Computer ein, um zu zeigen, dass der NIR-Bereich sehr nützlich für die quantitative Analyse ist, insbesondere bei landwirtschaftlichen Proben. Einer der Gründe, warum die NIR-Analyse so nützlich ist, liegt darin, dass sie reflektierte Energie nutzen kann und dies bedeutet, dass die NIR-Analyse mit wenig oder gar keiner Probenvorbereitung durchgeführt werden kann. Reflektierte Energie ist komplex. Erstens, weil es zwei Komponenten gibt, nämlich spiegelnde (oder spiegelähnliche) und diffuse. Im Zusammenhang mit der NIR-Spektroskopie liefert die spiegelnde Komponente keine Informationen. Die diffuse Komponente hängt von der physikalischen Beschaffenheit der Probe ab, wobei die Partikelgröße besonders wichtig ist. Die Variation der physikalischen Parameter einer Probe verursacht Veränderungen im Spektrum, so dass das beobachtete Spektrum eine Mischung aus chemischer und physikalischer Information ist.
Die Verwendung der reflektierten Energie wurde Karl Norris aufgezwungen. Sie ermöglicht zwar die NIR-Analyse eines sehr viel breiteren Spektrums von Proben, fügt aber eine weitere Ebene der Komplikation hinzu. Eine vollständige mathematische Theorie der Reflexionsspektroskopie ist noch nicht verfügbar, aber es hat sich gezeigt, dass es durch gute experimentelle Praxis und die Nutzung mathematischer Techniken möglich ist, die NIR-Reflexionsspektroskopie für die analytische Chemie einzusetzen. Da die Technik mit wenig oder gar keiner Probenvorbereitung angewandt werden kann, reduzieren sich die Analysezeiten von Stunden auf Minuten und darüber hinaus können mehrere analytische Ergebnisse aus denselben NIR-Daten gewonnen werden, während die konventionelle Analyse oft eine andere Technik und mehr Arbeitsstunden erfordern würde. Es ist jedoch notwendig, Kalibrierungen zu entwickeln, die viele Proben, viele Arbeitsstunden und Tausende (oder wahrscheinlich Millionen) von Computerberechnungen erfordern. Mit dieser Art von Eigenschaften ist es nicht verwunderlich, dass 40 Jahre nach der bahnbrechenden Forschung ein sehr breites Spektrum an Analysen mit der NIR-Spektroskopie durchgeführt werden kann.
Überraschend ist, dass es trotz des Erfolges der NIR-spektroskopischen Analyse weltweit nur sehr wenige universitäre Chemieabteilungen gibt, die ein Forschungsprogramm für NIR-Spektroskopie haben. Folglich verlässt die Mehrheit der Chemiestudenten die Universität ohne Wissen über NIR, mit der möglichen Ausnahme der altmodischen Ansicht, dass es nichts Nützliches über den NIR-Bereich zu lernen gibt.