Leitfrage
Welche Faktoren bestimmen, wie genau und wie präzise die Konzentration von Essigsäure in Essig bestimmt werden kann?
Einführung
Viele Labore analysieren Verbraucherprodukte, um die Genauigkeit der Produktkennzeichnung zu bestimmen. Die sehr verbreitete und einfache Technik der Titration wird in diesem Experiment demonstriert. Eine Titration ist ein analytisches Verfahren, bei dem eine Reaktion unter sorgfältig kontrollierten Bedingungen durchgeführt wird. Das stöchiometrische Volumen eines Reaktanten bekannter Konzentration, des Titranten, das benötigt wird, um mit einem anderen Reaktanten unbekannter Konzentration, dem Analyten, zu reagieren, wird gemessen. Die Konzentration des Analyten wird aus der Konzentration und dem Volumen des Titriermittels und der Stöchiometrie der Reaktion zwischen ihnen bestimmt. Der Versuchsaufbau ist in Abbildung 1 dargestellt. Eine Bürette, die das Titriermittel enthält, ist so kalibriert, dass das von ihr abgegebene Lösungsvolumen mit hoher Genauigkeit und Präzision bestimmt werden kann. Das Titriermittel wird dem Analyten zugegeben, bis das stöchiometrische Volumen des Titriermittels erreicht ist. Dies wird als Äquivalenzpunkt bezeichnet, an dem das von der Bürette abgegebene Volumen an Titriermittel abgelesen wird. In der Regel werden die Volumenwerte auf 0,01 mL genau abgeschätzt. Die Abgabe des Titriermittels wird mit dem Absperrhahn an der Bürette eingestellt. Mit etwas Übung kann man Bruchteile eines Tropfens Titriermittel dosieren und das Verfahren so gut kontrollieren, dass wiederholte Titrationen innerhalb von 0,10 mL übereinstimmen. Für dieses erste Labor müssen Ihre Titrationen innerhalb von 0,50 mL übereinstimmen.
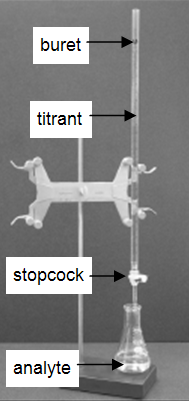
Abbildung 1: Titrationsaufbau
Oft wird der Äquivalenzpunkt visuell mit einem Indikator bestimmt. Der Indikator, eine Substanz, die sich in der Nähe des Äquivalenzpunktes verfärbt, wird der Analytlösung zugesetzt. Da der Farbumschlag in der Nähe, aber nicht genau am Äquivalenzpunkt stattfindet, wird der Punkt, an dem der Farbumschlag auftritt, als Endpunkt bezeichnet. Die Indikatoren werden so gewählt, dass der Endpunkt sehr nahe am Äquivalenzpunkt liegt. Es ist wichtig, eine Titration gut durchmischt zu halten, damit das Titriermittel und der Analyt miteinander in Kontakt kommen und schnell reagieren können. Es kann entweder manuelles Schwenken des Kolbens oder mechanisches Rühren verwendet werden. In diesem Experiment werden Sie das manuelle Schwenken verwenden. Die häufigste Art der Titration ist die Säure-Base-Titration. In diesem Experiment soll die Konzentration von Essigsäure, HC2H3O2, in handelsüblichem Essig bestimmt werden. Bei dieser Titration ist wässrige NaOH das Titriermittel und der Essig der Analyt. Wir nehmen an, dass die starke Base und die schwache Säure vollständig nach der Netzgleichung reagieren:
Die Bilanzgleichung zeigt eine 1:1-Stöchiometrie, wir können also schreiben:
Oder allgemeiner:
Mole der Base können aus Molarität mal Volumen berechnet werden
Zur Erinnerung an die Konzentrationseinheiten: Die Molarität ist definiert als die Anzahl der Mole des gelösten Stoffes in einem Liter Lösung (M = mol/L). Dies ist numerisch gleich der Anzahl der Millimol des gelösten Stoffes in einem Milliliter Lösung (M = mmol/mL). Es ist oft praktisch, diese zweite Definition der Molarität bei Titrationen und anderen Arbeiten zu verwenden, bei denen es um kleine Mengen geht. In 1 Mol sind 1000 mmol und in 1 Liter 1000 mL. Zum Beispiel enthalten 10,2 mL von 0,100 M NaOH-Lösung 1,02 mmol NaOH.
0.100 mmol NaOH
1 mol Lösung
= 1,02 mmol NaOH
Die Molarität der Säure lässt sich aus Molen geteilt durch das Volumen berechnen
In diesem Versuch wird ein sorgfältig abgemessenes Volumen an Essig
in einen Kolben gegeben und die Masse bestimmt. Anschließend wird die Essigprobe mit einer NaOH-Lösung bekannter Konzentration
titriert und das zum Erreichen des Endpunktes
erforderliche Volumen an NaOH-Lösung bestimmt.
und
sind bekannt, so dass die Konzentration der Säure
wie oben beschrieben bestimmt werden kann. Darüber hinaus kann die Masse der Essigsäure in der Probe aus der Anzahl der vorhandenen Mole und der molaren Masse der Essigsäure
Aus der Masse der Essigsäure in der Probe und der Masse der titrierten Essiglösung kann schließlich der Massenprozentanteil der Essigsäure im Essig bestimmt werden.
Masse der Essigsäure in der Probe
Masse der titrierten Essiglösung
× 100
Bei der Titration von Essigsäure mit wässriger NaOH wird Phenolphthalein als Indikator verwendet. Phenolphthalein ist in saurer Lösung fast farblos, färbt sich aber bei einem pH-Wert von etwa 8 rosa, was anzeigt, dass die Base die Säure vollständig neutralisiert hat. Wenn Sie den Essig titrieren, werden Sie feststellen, dass die rosa Farbe mit zunehmender Zugabe von Base beständiger wird. Dies ist ein Signal, die Zugabe der Base zu verlangsamen und sorgfältig zu kontrollieren. Der Endpunkt ist erreicht, wenn eine schwache rosa Farbe für mindestens 30 Sekunden anhält. Es ist leicht möglich, den Endpunkt zu überschreiten. Wenn dies geschieht, haben Sie eine dunkelviolett-rosa Lösung und müssen die Titration wiederholen, also seien Sie vorsichtig. Notieren Sie das verbrauchte Volumen, unterbrechen Sie dieses Volumen bei nachfolgenden Titrationen und geben Sie den letzten Milliliter tropfenweise hinzu. Ihr Ausbilder wird Ihnen zeigen, wie Sie den Absperrhahn der Bürette bedienen können, um dies zu erleichtern. Beachten Sie, dass die Volumenmessungen bei Titrationen in der Regel auf vier signifikante Stellen angegeben werden, so dass auch die Konzentrationen in der Regel auf vier signifikante Stellen angegeben werden. Achte bei deiner Arbeit darauf; wenn du molare Massen berechnest, achte darauf, dass du vier signifikante Zahlen angibst.
Ziele
Bei der Durchführung dieser Untersuchung wirst du:
-
1
Eine NaOH(aq)-Lösung standardisieren.
-
2
Titriere eine Essigprobe mit der standardisierten NaOH(aq)-Lösung.
-
3
Messen Sie die Dichte einer Essigprobe.
-
4
Berechnen Sie die Molarität und den Massenprozentanteil der Essigsäure in der Essigprobe.
Materialien zur Verwendung
- Essig
- NaOH(aq)-Lösung
- KHP – Kaliumhydrogenphthalat
- Phenolphthalein-Indikator
- 10-mL-Pipetten
- Becher
- Erlenmeyerkolben, 125 mL
- Bürettenständer mit Bürette
- Trichter
- Analysenwaagen
Sicherheitsvorkehrungen
NaOH ist ätzend. Es kann die Haut angreifen und bleibende Schäden an den Augen verursachen. Wenn NaOH-Lösung in Ihre Augen spritzt, benutzen Sie sofort die Augenspülstation. Halten Sie die Augen offen und spülen Sie mit Wasser. Bei Kontakt mit Haut oder Kleidung spülen Sie die betroffene Stelle mit Wasser. Lassen Sie Ihren Laborpartner Ihren Ausbilder über den Verschütteten informieren.
Getting Started
Ihre erste Aufgabe ist die Standardisierung der NaOH-Lösung mit dem Feststoff KHP (KC8H5O4, 204,22 g/mol). Das bedeutet, dass Sie seine Molarität auf mindestens drei signifikante Stellen bestimmen müssen. Sie benötigen mindestens drei Titrationen, die innerhalb von 1% übereinstimmen, wie im Verfahren beschrieben. Sie haben zwei weitere Aufgaben im Labor zu erledigen. Sie müssen die Dichte der Essiglösung und die Molarität der Essigsäure im Essig bestimmen. Um Ihre Aufgaben zu erfüllen, müssen Sie sehr genaue Volumen- und Massenmessungen durchführen. Büretten und Pipetten sind nützlich, um Volumina genau zu messen. Die Bürette und die Pipette werden in der Einführung und in den Videos beschrieben. Bevor Sie beginnen, vergewissern Sie sich, dass Sie ihre richtige Verwendung verstehen.
Vorgehensweise
Bitte drucken Sie das Arbeitsblatt für dieses Labor aus. Sie werden dieses Blatt benötigen, um Ihre Daten aufzuzeichnen.

Vorbereitung der Bürette
Überprüfen Sie die Bürette, indem Sie die Seiten mit einer Flasche destilliertem Wasser abspülen, um zu prüfen, ob Wasser im Inneren der Bürette „blättert“. Wenn Wassertropfen beobachtet werden, sollte die Bürette vor dem Gebrauch gewaschen werden. Achten Sie darauf, die innere Oberfläche nicht zu zerkratzen, wenn Sie eine Bürettenbürste zur Reinigung verwenden müssen. Spülen Sie die Bürette gut mit Leitungswasser ab, einschließlich des Hahns und der Unterlegscheiben. Spülen Sie dann die Wände der Bürette mit deionisiertem/destilliertem Wasser ab.
Schließlich spülen Sie die Bürette mindestens ZWEIMAL mit kleinen Portionen Ihrer NaOH-Lösung, um sicherzustellen, dass alles Wasser entfernt ist. Lassen Sie die Lösung durch die Spitze auslaufen.
Füllen Sie die Bürette mit Hilfe eines Trichters mit NaOH-Lösung.
Um nach dem Befüllen die Luftblasen in der Spitze der Bürette zu entfernen, den Absperrhahn mehrmals schnell öffnen und schließen. Hinweis: Wenn der Absperrhahn korrekt mit der Bürettenspitze ausgerichtet ist, sind die eingeschlossenen Luftblasen nicht so stark ausgeprägt. Wenden Sie sich an den Ausbilder, wenn die Blasen weiterhin bestehen.
Standardisierung mit KHP
Verwenden Sie ~1 Gramm KHP. NOTIEREN SIE DIE MASSE SOFORT IN DER DATENTABELLE.
Verwenden Sie die Waschflasche mit destilliertem Wasser, um sicherzustellen, dass alle Proben in den Kolben überführt wurden.
Geben Sie etwa 50 mL destilliertes Wasser und zwei bis drei Tropfen Indikator hinzu. Der Indikator Phenolphthalein wird in diesem Titrationsversuch verwendet. Verwenden Sie nicht zu viel Indikator, da Sie sonst auch dieses Molekül titrieren werden. Achten Sie darauf, dass Sie in allen Proben die gleiche Anzahl von Tropfen verwenden.
Titrationstechnik
Legen Sie ein Blatt weißes Papier unter den Auffangkolben, um den Endpunkt besser beobachten zu können.
Verwenden Sie eine geteilte weiße Karte oben/schwarz unten, um das Ablesen des Meniskus zu erleichtern. Wenn Sie die Karte hinter die Bürette legen und die schwarze Linie direkt unter dem Meniskus platzieren, wird der Meniskus zum leichteren Ablesen dunkel. Notieren Sie das anfängliche Volumen der NaOH-Lösung auf den nächsten Hundertstel Milliliter (±0,01 ml) in der Datentabelle Ihres Notizbuchs.
Das Titriermittel (NaOH-Lösung in der Bürette) kann anfangs recht schnell zugegeben werden, aber wenn man sich dem Endpunkt nähert, sollte die Zugabe verlangsamt werden. Wenn Sie Rechtshänder sind, ist es schneller, das Titriermittel mit der linken Hand zuzugeben und dabei mit der rechten Hand zu schwenken (umgekehrt für Linkshänder). Je mehr man sich dem Endpunkt nähert, desto länger bleibt die rosa Farbe bestehen. In der Nähe des Endpunkts spülen Sie die Kolbenwände mit destilliertem Wasser ab, um sicherzustellen, dass die gesamte zugesetzte NaOH-Base reagiert hat.
Wenn Sie sehr nahe am Endpunkt sind, suspendieren Sie einen halben Tropfen Base an der Spitze der Bürette und spülen Sie den Tropfen mit der Spülflasche mit destilliertem Wasser in den Auffangkolben. Eine andere Methode, um einen Bruchteil eines Tropfens hinzuzufügen, besteht darin, den Absperrhahn sehr schnell um 180 Grad zu drehen; Sie können jedoch versehentlich zu viel Base hinzufügen, wenn Sie diese Technik falsch ausführen.
Der Endpunkt tritt ein, wenn das Phenolphthalein von klar zu der schwächsten rosa Farbe wechselt, die Sie sehen können, und für mindestens 30 Sekunden anhält. Notieren Sie das endgültige Volumen der NaOH-Lösung auf den nächsten hundertstel Milliliter (±0,01 ml) in der Datentabelle. Bestimmen Sie anschließend die Menge der für die Titration verwendeten NaOH-Lösung.
Ihre Gruppe muss ein MINIMUM von VIER VERSUCHEN durchführen und drei Versuche müssen innerhalb von ±1% übereinstimmen. Abhängig von Ihrer Technik können Sie sogar mehr machen. SIE KÖNNEN DIE DATEN NICHT EINFACH „DURCHSTREICHEN“, WEIL SIE IHNEN NICHT GEFALLEN; SIE MÜSSEN DEN GRUND FÜR DIE VERWERFUNG ANGEBEN. Der Grund kann offensichtlich sein, wie z. B. „Endpunkt überschritten“, oder Sie können nur Werte verwerfen, die auf statistischen Tests basieren.
Molarität der Essigsäure in Essig
Konditionieren Sie die Bürette mit standardisierter NaOH aus der Vorwoche.
Konditionieren Sie eine 10-mL-Pipette mit der Essiglösung.
Messen Sie 10 mL Essig in einen Erlenmeyerkolben ab und geben Sie Phenolphthalein-Indikator hinzu.
Titrieren Sie mit dem Standard NaOH aus dem vorherigen Labor.
Interaktive Postersitzung
Wenn Ihre Gruppe ihre Arbeit abgeschlossen hat, bereiten Sie ein Whiteboard vor, auf dem Sie Ihre Ideen präsentieren und begründen können. Siehe das mitgelieferte Handout für Details zu diesem Prozess.
Bericht
Sobald Sie Ihre Forschung abgeschlossen haben, müssen Sie einen Untersuchungsbericht erstellen, der aus drei Abschnitten besteht. Dieser Bericht kann mehr als zwei Seiten mit Datentabellen erfordern. Dieser Bericht muss mit der Schreibmaschine geschrieben werden und alle Diagramme, Abbildungen oder Tabellen sollten in das Dokument eingebettet werden.
- Abschnitt 1: Welches Konzept bzw. welche Technik haben Sie untersucht, und wie hängt es mit der Leitfrage zusammen? Welche Faktoren bestimmen, wie genau und wie präzise die Konzentration von Essigsäure in Essig bestimmt werden kann? Beschreiben Sie die Titration und ihre Verwendung in Verbindung mit der molaren Stöchiometrie zur Bestimmung der Konzentration.
- Abschnitt 2: Wie sind Sie bei Ihrer Arbeit vorgegangen und warum haben Sie Ihre Untersuchung auf diese Weise durchgeführt? Insbesondere, welche Maßnahmen haben Sie ergriffen, um die Richtigkeit und Präzision zu gewährleisten?
- Abschnitt 3: Das Argument in dieser Untersuchung ist nicht so sehr für Ihr Ergebnis, sondern für die Gültigkeit und Zuverlässigkeit Ihrer Daten. Dieser Bericht sollte eine umfassende Datentabelle enthalten, ähnlich der, die Sie in der Übung vor dem Labor verwendet haben, in der Sie die Molarität Ihrer Base ermittelt haben. Berichten Sie nicht über den Standardisierungsprozess der Base, sondern nur über die NaOH-Molarität mit Standardabweichung. Sie müssen begründen, warum Sie einen der Essigtitrierungsversuche verworfen haben. Sie sollten eine vollständige Berechnung der Molarität und des Massenanteils des Essigs zeigen. Ihre endgültige Antwort für die Molarität des Essigs sollte eine Standardabweichung enthalten.
- In diesem dritten Abschnitt präsentieren Sie nicht nur Ihre Daten, sondern verwenden die erhaltenen Werte als Beweis für Ihre Argumentation. Aussagen wie „siehe Datentabelle für Werte“ sind nicht akzeptabel!