Löslichkeit
Warum lösen sich manche Feststoffe in Wasser?
Der Zucker, den wir zum Süßen von Kaffee oder Tee verwenden, ist ein molekularer Feststoff, bei dem die einzelnen Moleküle durch relativ schwache zwischenmolekulare Kräfte zusammengehalten werden. Wenn sich Zucker in Wasser auflöst, werden die schwachen Bindungen zwischen den einzelnen Saccharose-Molekülen gebrochen, und diese C12H22O11-Moleküle werden in die Lösung freigesetzt.
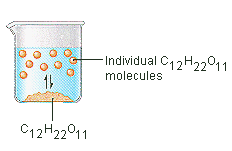
Es braucht Energie, um die Bindungen zwischen den C12H22O11-Molekülen in Saccharose zu brechen. Es braucht auch Energie, um die Wasserstoffbrückenbindungen im Wasser zu brechen, die unterbrochen werden müssen, um eines dieser Saccharose-Moleküle in Lösung zu bringen. Zucker löst sich in Wasser auf, weil Energie abgegeben wird, wenn die leicht polaren Saccharosemoleküle intermolekulare Bindungen mit den polaren Wassermolekülen eingehen. Die schwachen Bindungen, die sich zwischen dem gelösten Stoff und dem Lösungsmittel bilden, kompensieren die Energie, die benötigt wird, um die Struktur sowohl des reinen gelösten Stoffes als auch des Lösungsmittels zu zerstören. Im Fall von Zucker und Wasser funktioniert dieser Prozess so gut, dass sich bis zu 1800 Gramm Saccharose in einem Liter Wasser lösen können.
Ionische Feststoffe (oder Salze) enthalten positive und negative Ionen, die durch die starke Anziehungskraft zwischen Teilchen mit entgegengesetzten Ladungen zusammengehalten werden. Wenn sich einer dieser Feststoffe in Wasser auflöst, werden die Ionen, die den Feststoff bilden, in die Lösung freigesetzt, wo sie sich mit den polaren Lösungsmittelmolekülen verbinden.

| H2O | NaCl(s) | Na+(aq) | + | Cl-(aq) |
Im Allgemeinen können wir davon ausgehen, dass Salze in ihre Ionen dissoziieren, wenn sie sich in Wasser lösen. Ionische Verbindungen lösen sich in Wasser, wenn die Energie, die bei der Wechselwirkung der Ionen mit den Wassermolekülen abgegeben wird, die Energie kompensiert, die benötigt wird, um die Ionenbindungen im Festkörper aufzubrechen und die Energie, die benötigt wird, um die Wassermoleküle zu trennen, damit die Ionen in die Lösung eingebracht werden können.
![]()
Löslichkeitsgleichgewichte
Diskussionen über Löslichkeitsgleichgewichte gehen von folgender Annahme aus: Wenn sich Feststoffe in Wasser lösen, dissoziieren sie zu den Elementarteilchen, aus denen sie entstanden sind. Also molecular solids dissociate to give individual molecules
| H2O | ||
| C12H22O11(s) | C12H22O11(aq) |
und ionische Feststoffe dissoziieren zu Lösungen der in ihnen enthaltenen positiven und negativen Ionen.
| H2O | NaCl(s) | Na+(aq) | + | Cl-(aq) |
Wenn das Salz zuerst zugegeben wird, löst es sich und dissoziiert schnell. Die Leitfähigkeit der Lösung steigt daher zunächst schnell an.
| Auflösen | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) | |
| dissoziieren |

Die Konzentrationen dieser Ionen werden bald so groß, dass die Rückreaktion beginnt, mit der Vorwärtsreaktion zu konkurrieren, Dies führt zu einer Abnahme der Geschwindigkeit, mit der Na+ und Cl- Ionen in die Lösung gelangen.
| Assoziieren | Na+(aq) | + | Cl-(aq) | NaCl(s) |
| Niederschlag |
Eventually, werden die Na+- und Cl- Ionenkonzentrationen groß genug, dass die Rate, mit der die Ausfällung stattfindet, genau die Rate ausgleicht, mit der sich NaCld auflöst. Sobald dies der Fall ist, ändert sich die Konzentration dieser Ionen mit der Zeit nicht mehr und die Reaktion ist im Gleichgewicht. Wenn dieses System das Gleichgewicht erreicht, wird es als gesättigte Lösung bezeichnet, da es die maximale Konzentration an Ionen enthält, die im Gleichgewicht mit dem festen Salz existieren kann. Die Menge an Salz, die zu einem gegebenen Volumen an Lösungsmittel hinzugefügt werden muss, um eine gesättigte Lösung zu bilden, wird als Löslichkeit des Salzes bezeichnet.
![]()
Löslichkeitsregeln
Es gibt eine Reihe von Mustern in den Daten, die man durch die Messung der Löslichkeit verschiedener Salze erhält. Diese Muster bilden die Grundlage für die in der folgenden Tabelle dargestellten Regeln, die eine Vorhersage darüber ermöglichen, ob sich ein bestimmtes Salz in Wasser auflösen wird. Diese Regeln basieren auf den folgenden Definitionen der Begriffe löslich, unlöslich und schwer löslich.
- Ein Salz ist löslich, wenn es sich in Wasser auflöst und eine Lösung mit einer Konzentration von mindestens 0,1 Mol pro Liter bei Raumtemperatur ergibt.
- Ein Salz ist unlöslich, wenn die Konzentration in einer wässrigen Lösung bei Raumtemperatur kleiner als 0,001 M ist.
- Schwerlösliche Salze ergeben Lösungen, die zwischen diesen Extremen liegen.
Löslichkeitsregeln für ionische Verbindungen in Wasser
Lösliche Salze
1. Die Ionen Na+, K+ und NH4+ bilden lösliche Salze. So sind NaCl, KNO3, (NH4)2SO4, Na2S und (NH4)2CO3 löslich.
2. Das Nitrat (NO3-) Ion bildet lösliche Salze. So sind Cu(NO3)2 und Fe(NO3)3 löslich.
3. Die Ionen Chlorid (Cl-), Bromid (Br-) und Jodid (I-) bilden im Allgemeinen lösliche Salze. Ausnahmen sind Salze der Ionen Pb2+, Hg22+, Ag+ und Cu+. ZnCl2 ist löslich, CuBr jedoch nicht.
4. Das Sulfat (SO42-)-Ion bildet im Allgemeinen lösliche Salze. Ausnahmen sind BaSO4, SrSO4 und PbSO4, die unlöslich sind, und Ag2SO4, CaSO4 und Hg2SO4, die schwer löslich sind.
Unlösliche Salze
1. Sulfide (S2-) sind in der Regel unlöslich. Ausnahmen sind Na2S, K2S, (NH4)2S, MgS, CaS, SrS und BaS.
2. Oxide (O2-) sind normalerweise unlöslich. Ausnahmen sind Na2O, K2O, SrO und BaO, die löslich sind, und CaO, das leicht löslich ist.
3. Hydroxide (OH-) sind normalerweise unlöslich. Ausnahmen sind NaOH, KOH, Sr(OH)2 und Ba(OH)2, die löslich sind, und Ca(OH)2, das schwer löslich ist.
4. Chromate (CrO42-) sind normalerweise unlöslich. Ausnahmen sind Na2CrO4, K2CrO4, (NH4)2CrO4, und MgCrO4.
5. Phosphate (PO43-) und Carbonate (CO32-) sind in der Regel unlöslich. Ausnahmen sind Salze der Na+-, K+- und NH4+-Ionen.
![]()