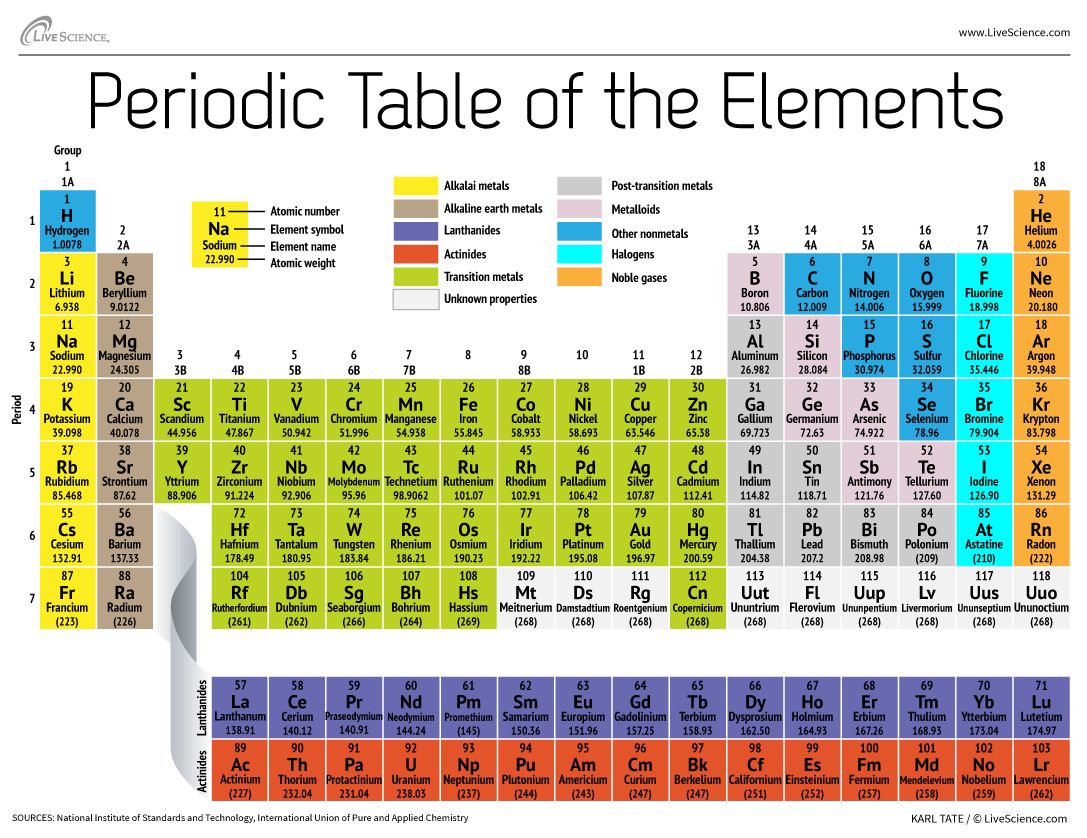
Das Periodensystem der Elemente ordnet alle bekannten chemischen Elemente in einer informativen Reihe an. Die Elemente sind von links nach rechts und von oben nach unten in der Reihenfolge der aufsteigenden Ordnungszahl angeordnet. Die Reihenfolge stimmt im Allgemeinen mit der zunehmenden Atommasse überein.
Die Reihen werden Perioden genannt. Die Periodennummer eines Elements bedeutet das höchste Energieniveau, das ein Elektron in diesem Element einnimmt (im nicht angeregten Zustand), so das Los Alamos National Laboratory. Die Anzahl der Elektronen in einer Periode nimmt zu, je weiter man sich im Periodensystem nach unten bewegt; daher steigt mit zunehmendem Energieniveau des Atoms auch die Anzahl der Unterebenen pro Energieniveau.
Elemente, die dieselbe Spalte im Periodensystem belegen (eine sogenannte „Gruppe“), haben identische Valenzelektronenkonfigurationen und verhalten sich folglich chemisch ähnlich. Zum Beispiel sind alle Elemente der Gruppe 18 Edelgase.
‚Vater‘ des Periodensystems
Dmitri Mendelejew, ein russischer Chemiker und Erfinder, gilt laut der Royal Society of Chemistry als „Vater“ des Periodensystems. In den 1860er Jahren war Mendelejew ein beliebter Dozent an einer Universität in St. Petersburg, Russland. Da es zu dieser Zeit keine modernen Lehrbücher für organische Chemie in russischer Sprache gab, beschloss Mendelejew, eines zu schreiben und gleichzeitig das Problem der ungeordneten Elemente anzugehen.
Die Elemente in irgendeine Art von Ordnung zu bringen, würde sich als ziemlich schwierig erweisen. Zu diesem Zeitpunkt war weniger als die Hälfte der Elemente bekannt, und einige davon waren falsch angegeben worden. Es war wie die Arbeit an einem wirklich schwierigen Puzzle mit nur der Hälfte der Teile und mit einigen der Teile unförmig.
Mendelejew schrieb schließlich das definitive Chemie-Lehrbuch seiner Zeit, mit dem Titel „Principles of Chemistry“ (zwei Bände, 1868-1870), laut Khan Academy. Während er daran arbeitete, stieß er auf eine bedeutende Entdeckung, die wesentlich zur Entwicklung des heutigen Periodensystems beitragen sollte. Nachdem er die Eigenschaften der Elemente auf Karten geschrieben hatte, begann er, sie nach zunehmendem Atomgewicht zu ordnen, so die Royal Society of Chemistry. Dabei bemerkte er, dass bestimmte Arten von Elementen regelmäßig auftauchten. Nachdem er drei Tage lang intensiv an diesem „Puzzle“ gearbeitet hatte, sagte Mendelejew, dass er einen Traum hatte, in dem alle Elemente wie gewünscht an ihren Platz fielen. Als er aufwachte, schrieb er sie sofort auf ein Blatt Papier – nur an einer Stelle schien eine Korrektur notwendig, sagte er später.
Mendelejew ordnete die Elemente sowohl nach dem Atomgewicht als auch nach der Wertigkeit. Er ließ nicht nur Platz für noch nicht entdeckte Elemente, sondern sagte auch die Eigenschaften von fünf dieser Elemente und ihrer Verbindungen voraus. Im Jahr 1869 präsentierte er die Ergebnisse vor der Russischen Chemischen Gesellschaft. Sein neues Periodensystem wurde in der deutschen Zeitschrift fϋr Chemie veröffentlicht.
Lesen der Tabelle
Das Periodensystem enthält eine enorme Menge an wichtigen Informationen:
Atomzahl: Die Anzahl der Protonen in einem Atom wird als Ordnungszahl des jeweiligen Elements bezeichnet. Die Anzahl der Protonen definiert, um welches Element es sich handelt und bestimmt auch das chemische Verhalten des Elements. Zum Beispiel haben Kohlenstoffatome sechs Protonen, Wasserstoffatome eines und Sauerstoffatome acht.
Atomsymbol: Das Atomsymbol (oder Elementsymbol) ist eine Abkürzung, die zur Darstellung eines Elements gewählt wird („C“ für Kohlenstoff, „H“ für Wasserstoff und „O“ für Sauerstoff usw.). Diese Symbole werden international verwendet und sind manchmal unerwartet. Zum Beispiel ist das Symbol für Wolfram „W“, weil ein anderer Name für dieses Element Wolfram ist. Auch das Atomsymbol für Gold ist „Au“, weil das Wort für Gold im Lateinischen aurum ist.
Atomgewicht: Das Standard-Atomgewicht eines Elements ist die durchschnittliche Masse des Elements in atomaren Masseneinheiten (amu). Einzelne Atome haben immer eine ganzzahlige Anzahl von Atommasseneinheiten; die Atommasse im Periodensystem wird jedoch als Dezimalzahl angegeben, da sie ein Durchschnitt der verschiedenen Isotope eines Elements ist. Die durchschnittliche Anzahl der Neutronen für ein Element kann durch Subtraktion der Anzahl der Protonen (Ordnungszahl) von der Atommasse ermittelt werden.
Atomgewicht für die Elemente 93-118: Für natürlich vorkommende Elemente wird das Atomgewicht aus der Mittelung der Gewichte der natürlichen Häufigkeiten der Isotope dieses Elements berechnet. Für im Labor hergestellte Trans-Uran-Elemente – Elemente mit Ordnungszahlen höher als 92 – gibt es jedoch keine „natürliche“ Häufigkeit. Die Konvention ist, das Atomgewicht des langlebigsten Isotops im Periodensystem anzugeben. Diese Atomgewichte sollten als vorläufig betrachtet werden, da in der Zukunft ein neues Isotop mit einer längeren Halbwertszeit hergestellt werden könnte.
Zu dieser Kategorie gehören die überschweren Elemente, oder solche mit Ordnungszahlen über 104. Je größer der Atomkern ist – die Anzahl der Protonen im Inneren steigt – desto instabiler ist das Element im Allgemeinen. Als solche sind diese übergroßen Elemente flüchtig und halten nur Millisekunden, bevor sie in leichtere Elemente zerfallen, so die International Union of Pure and Applied Chemistry (IUPAC). So wurden die überschweren Elemente 113, 115, 117 und 118 im Dezember 2015 von der IUPAC verifiziert und vervollständigen die siebte Reihe, oder Periode, auf der Tabelle. Die superschweren Elemente wurden von mehreren verschiedenen Labors hergestellt. Die Ordnungszahlen, vorläufigen Namen und offiziellen Bezeichnungen sind:
- 113: Ununtrium (Uut), Nihonium (Nh)
- 115: Ununpentium (Uup), Moscovium (Mc)
- 117: Ununseptium (Uus), Tennessin (Ts)
- 118: Ununoctium (Uuo), Oganesson (Og)
Zusätzliche Berichterstattung von Traci Pedersen, Live Science-Mitarbeiterin
Aktuelle Nachrichten