Hauptunterschied – Elektronengeometrie vs. Molekulargeometrie
Die Geometrie eines Moleküls bestimmt die Reaktivität, Polarität und biologische Aktivität dieses Moleküls. Die Geometrie eines Moleküls kann entweder als Elektronengeometrie oder als Molekulargeometrie angegeben werden. Die VSEPR-Theorie (Valence Shell Electron Pair Repulsion theory) kann zur Bestimmung der Geometrien von Molekülen verwendet werden. Die Elektronengeometrie umfasst die in einem Molekül vorhandenen Einzelelektronenpaare. Die Molekülgeometrie kann durch die Anzahl der Bindungen, die ein bestimmtes Molekül hat, bestimmt werden. Der Hauptunterschied zwischen der Elektronengeometrie und der molekularen Geometrie besteht darin, dass die Elektronengeometrie sowohl durch die Einzelelektronenpaare als auch durch die Bindungen in einem Molekül bestimmt wird, während die molekulare Geometrie nur durch die im Molekül vorhandenen Bindungen bestimmt wird.
Key Areas Covered
1. Was ist Elektronengeometrie
– Definition, Identifikation, Beispiele
2. Was ist Molekülgeometrie
– Definition, Identifikation, Beispiele
3. Was sind Geometrien von Molekülen
– Erläuternde Tabelle
4. Was ist der Unterschied zwischen Elektronengeometrie und Molekülgeometrie
– Gegenüberstellung der wichtigsten Unterschiede
Schlüsselbegriffe: Elektronengeometrie, Einsames Elektronenpaar, Molekülgeometrie, VSEPR-Theorie

Was ist Elektronengeometrie
Die Elektronengeometrie ist die Form eines Moleküls, die durch die Berücksichtigung von gebundenen Elektronenpaaren und Einzelelektronenpaaren vorhergesagt wird. Die VSEPR-Theorie besagt, dass Elektronenpaare, die sich um ein bestimmtes Atom befinden, sich gegenseitig abstoßen. Diese Elektronenpaare können entweder Bindungselektronen oder Nicht-Bindungselektronen sein.
Die Elektronengeometrie gibt die räumliche Anordnung aller Bindungen und Freiraumelektronenpaare eines Moleküls an. Die Elektronengeometrie kann mit Hilfe der VSEPR-Theorie ermittelt werden.
Wie bestimmt man die Elektronengeometrie
Nachfolgend sind die Schritte zur Bestimmung aufgeführt.
- Bestimmen Sie das Zentralatom des Moleküls. Es sollte das elektronegativste Atom sein.
- Bestimmen Sie die Anzahl der Valenzelektronen des Zentralatoms.
- Bestimmen Sie die Anzahl der von anderen Atomen abgegebenen Elektronen.
- Berechnen Sie die Gesamtzahl der Elektronen um das Zentralatom.
- Dividieren Sie diese Zahl durch 2. Dies ergibt die Anzahl der vorhandenen Elektronengruppen.
- Ziehen Sie die Anzahl der vorhandenen Einfachbindungen um das Zentralatom von der oben erhaltenen sterischen Zahl ab. Daraus ergibt sich die Anzahl der im Molekül vorhandenen Einzelelektronenpaare.
- Bestimmen Sie die Elektronengeometrie.
Beispiele
Elektronengeometrie von CH4
Zentralatom des Moleküls = C
Anzahl der Valenzelektronen von C = 4
Anzahl der von Wasserstoffatomen abgegebenen Elektronen = 4 x (H)
= 4 x 1 = 4
Gesamtzahl der Elektronen um C = 4 + 4 = 8
Anzahl der Elektronengruppen = 8 / 2 = 4
Anzahl der vorhandenen Einfachbindungen = 4
Anzahl der einsamen Elektronenpaare = 4 – 4 = 0
Daher, die Elektronengeometrie = tetraedrisch
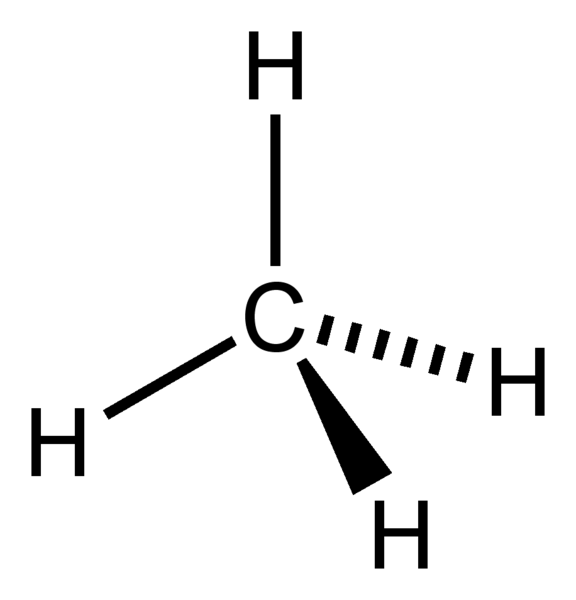
Abbildung 1: Elektronengeometrie von CH4
Elektronengeometrie von Ammoniak (NH3)
Zentralatom des Moleküls = N
Anzahl der Valenzelektronen von N = 5
Anzahl der von Wasserstoffatomen abgegebenen Elektronen = 3 x (H)
= 3 x 1 = 3
Gesamtzahl der Elektronen um N = 5 + 3 = 8
Anzahl der Elektronengruppen = 8 / 2 = 4
Anzahl der vorhandenen Einfachbindungen = 3
Anzahl der einsamen Elektronenpaare = 4 – 3 = 1
Daher, die Elektronengeometrie = tetraedrisch
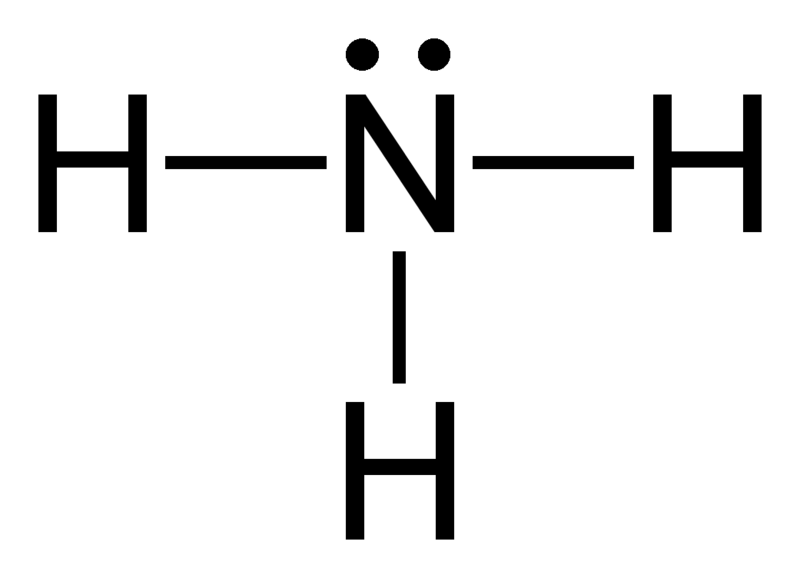
Abbildung 2: Elektronengeometrie von Ammoniak
Elektronengeometrie von AlCl3
Zentralatom des Moleküls = Al
Anzahl der Valenzelektronen von Al = 3
Anzahl der von Cl-Atomen abgegebenen Elektronen = 3 x (Cl)
= 3 x 1 = 3
Gesamtzahl der Elektronen um N = 3 + 3 = 6
Anzahl der Elektronengruppen = 6 / 2 = 3
Anzahl der vorhandenen Einfachbindungen = 3
Anzahl der einsamen Elektronenpaare = 3 – 3 = 0
Daher, die Elektronengeometrie = trigonal planar

Abbildung 3: Elektronengeometrie von AlCl3
Gelegentlich sind die Elektronengeometrie und die Molekülgeometrie gleich. Das liegt daran, dass bei der Bestimmung der Geometrie nur Bindungselektronen in Abwesenheit von Einzelelektronenpaaren berücksichtigt werden.
Was ist molekulare Geometrie
Molekulare Geometrie ist die Form eines Moleküls, die vorhergesagt wird, wenn nur Bindungselektronenpaare berücksichtigt werden. In diesem Fall werden die Einzelelektronenpaare nicht berücksichtigt. Außerdem werden Doppelbindungen und Dreifachbindungen wie Einfachbindungen betrachtet. Die Geometrien werden aufgrund der Tatsache bestimmt, dass Einzelelektronenpaare mehr Platz benötigen als Bindungselektronenpaare. Wenn ein bestimmtes Molekül beispielsweise aus zwei Bindungselektronenpaaren zusammen mit einem einsamen Elektronenpaar besteht, ist die Molekülgeometrie nicht linear. Die Geometrie ist dort „gebogen oder eckig“, weil das einsame Elektronenpaar mehr Platz benötigt als zwei bindende Elektronenpaare.
Beispiele der Molekülgeometrie
Molekülgeometrie von H2O
Zentralatom des Moleküls = O
Anzahl der Valenzelektronen von O = 6
Anzahl der von Wasserstoffatomen abgegebenen Elektronen = 2 x (H)
= 2 x 1 = 2
Gesamtzahl der Elektronen um N = 6 + 2 = 8
Anzahl der Elektronengruppen = 8 / 2 = 4
Anzahl der einsamen Elektronenpaare = 2
Anzahl der vorhandenen Einfachbindungen = 4 – 2 = 2
Daher, Elektronengeometrie = Bent
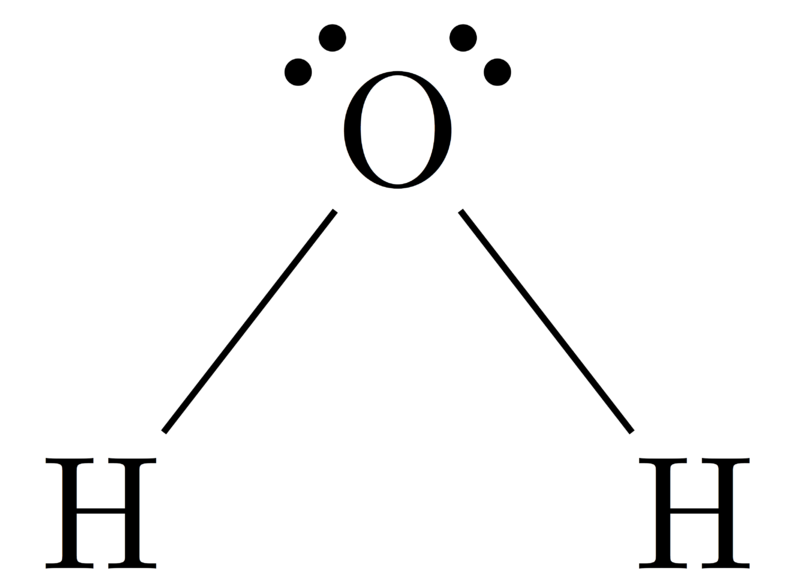
Abbildung 4: Molekülgeometrie von H2O
Molekülgeometrie von Ammoniak (NH3)
Zentralatom des Moleküls = N
Anzahl der Valenzelektronen von N = 5
Anzahl der von Wasserstoffatomen abgegebenen Elektronen = 3 x (H)
= 3 x 1 = 3
Gesamtzahl der Elektronen um N = 5 + 3 = 8
Anzahl der Elektronengruppen = 8 / 2 = 4
Anzahl der einsamen Elektronenpaare = 1
Anzahl der vorhandenen Einfachbindungen = 4 – 1 = 3
Daher, Elektronengeometrie = trigonale Pyramide
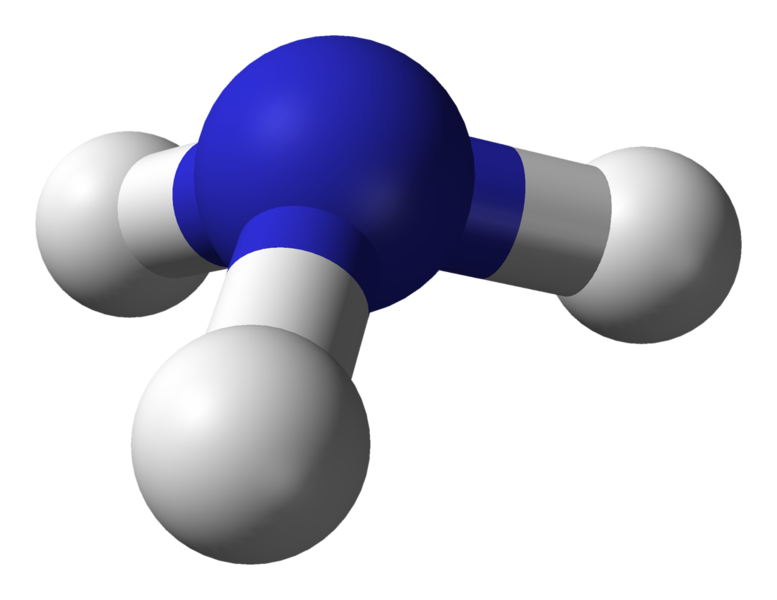
Abbildung 5: Kugel- und Stabstruktur für Ammoniakmolekül
Die Elektronengeometrie von Ammoniak ist tetraedrisch. Aber die Molekülgeometrie von Ammoniak ist trigonale Pyramide.
Geometrie von Molekülen
Die folgende Tabelle zeigt einige Geometrien von Molekülen nach der Anzahl der vorhandenen Elektronenpaare.
|
Anzahl der Elektronenpaare |
Anzahl der bindenden Elektronen Paare |
Anzahl der einsamen Elektronenpaare |
Elektronengeometrie |
Molekulare Geometrie |
Linear |
Linear |
|
Trigonal planar |
Trigonal planar |
Trigonal planar |
Gebogen |
Tetraeder |
Tetraeder |
|
Tetraeder |
Trigonale Pyramide |
||||
|
Tetraedrisch |
Gebogen |
||||
|
Trigonal bypyramidal |
Trigonal bypyramidal |
||||
|
Trigonal bypyramidal |
Seesäge |
Trigonal bypyramidal |
T-geformt |
||
|
Trigonal bypyramidal |
Linear |
||||
|
Oktaedrisch |
Oktaedrisch |
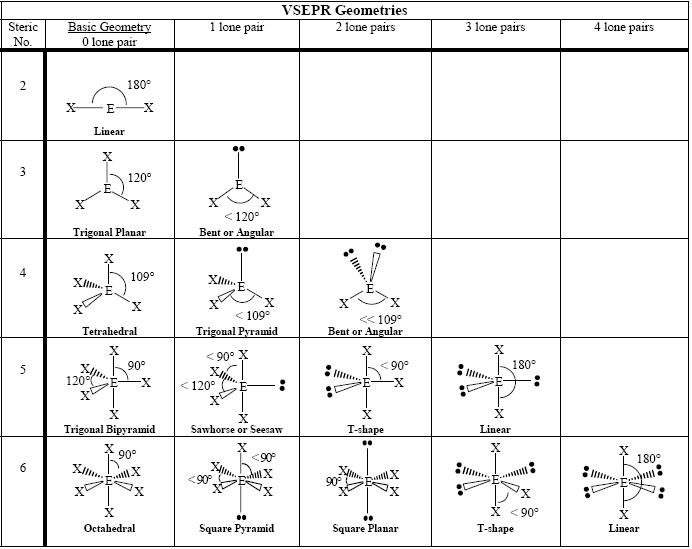
Abbildung 6: Grundlegende Geometrien von Molekülen
Die obige Tabelle zeigt grundlegende Geometrien von Molekülen. Die erste Spalte der Geometrien zeigt die Elektronengeometrien. Die anderen Spalten zeigen Molekülgeometrien einschließlich der ersten Spalte.
Unterschied zwischen Elektronengeometrie und Molekülgeometrie
Definition
Elektronengeometrie: Die Elektronengeometrie ist die Form eines Moleküls, die durch die Berücksichtigung sowohl von Bindungselektronenpaaren als auch von Einzelelektronenpaaren vorhergesagt wird.
Molekulare Geometrie: Die Molekülgeometrie ist die Form eines Moleküls, die durch die Berücksichtigung von nur Bindungselektronenpaaren vorhergesagt wird.
Einzelelektronenpaare
Elektronengeometrie: Einzelelektronenpaare werden bei der Bestimmung der Elektronengeometrie berücksichtigt.
Molekulare Geometrie: Einsame Elektronenpaare werden bei der Ermittlung der Molekülgeometrie nicht berücksichtigt.
Anzahl der Elektronenpaare
Elektronengeometrie: Die Anzahl der gesamten Elektronenpaare sollte berechnet werden, um die Elektronengeometrie zu finden.
Molekulare Geometrie: Die Anzahl der bindenden Elektronenpaare sollte berechnet werden, um die molekulare Geometrie zu finden.
Schlussfolgerung
Elektronengeometrie und molekulare Geometrie sind gleich, wenn es keine einsamen Elektronenpaare am Zentralatom gibt. Gibt es aber Einzelelektronenpaare am Zentralatom, so unterscheidet sich die Elektronengeometrie immer von der Molekülgeometrie. Der Unterschied zwischen Elektronengeometrie und Molekülgeometrie hängt also von den in einem Molekül vorhandenen Einzelelektronenpaaren ab.
1. „Molecular Geometry“. N.p., n.d. Web. Verfügbar hier. 27. Juli 2017.
2. „VSEPR-Theorie.“ Wikipedia. Wikimedia Foundation, 24. Juli 2017. Web. Verfügbar hier. 27. Juli 2017.
Image Courtesy:
1. „Methan-2D-klein“ (Public Domain) via Commons Wikimedia
2. „Ammoniak-2D-flach“ By Benjah-bmm27 – Own work (Public Domain) via Commons Wikimedia
3. „AlCl3“ von Dailly Anthony – Eigenes Werk (CC BY-SA 3.0) via Commons Wikimedia
4. „H2O Lewis Structure PNG“ von Daviewales – Eigenes Werk (CC BY-SA 4.0) via Commons Wikimedia
5. „Ammonia-3D-balls-A“ By Ben Mills – Own work (Public Domain) via Commons Wikimedia
6. „VSEPR geometries“ By Dr. Regina Frey, Washington University in St. Louis – Own work, Public Domain) via Commons Wikimedia
![]()