Objectifs d’apprentissage
- Nommer les acides carboxyliques avec des noms communs.
- Nommer les acides carboxyliques selon la nomenclature UICPA.
Les acides carboxyliques sont largement présents dans la nature, souvent combinés avec des alcools ou d’autres groupes fonctionnels, comme dans les graisses, les huiles et les cires. Ils sont des composants de nombreux aliments, médicaments et produits ménagers (figure \(\PageIndex{1}\)). Il n’est pas surprenant que beaucoup d’entre eux soient mieux connus par des noms communs basés sur des mots latins et grecs qui décrivent leur source.
L’acide carboxylique le plus simple, l’acide formique (HCOOH), a été obtenu pour la première fois par la distillation de fourmis (latin formica, qui signifie « fourmi »). Les morsures de certaines fourmis injectent de l’acide formique, et les piqûres de guêpes et d’abeilles en contiennent (ainsi que d’autres matières toxiques).

L’homologue supérieur suivant est l’acide acétique, qui est fabriqué par la fermentation du cidre et du miel en présence d’oxygène. Cette fermentation produit du vinaigre, une solution contenant de 4 à 10 % d’acide acétique, plus un certain nombre d’autres composés qui ajoutent à sa saveur. L’acide acétique est probablement l’acide faible le plus familier utilisé dans les laboratoires de chimie éducative et industrielle.
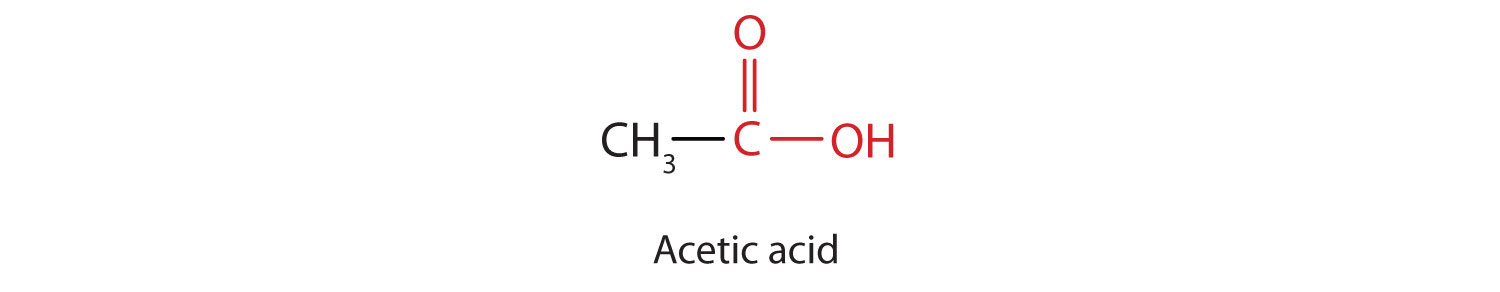
L’acide acétique pur se solidifie à 16,6°C, à peine en dessous de la température ambiante normale. Dans les laboratoires mal chauffés de la fin du XIXe siècle et du début du XXe siècle dans le nord de l’Amérique du Nord et en Europe, l’acide acétique » gelait » souvent sur l’étagère de stockage. Pour cette raison, l’acide acétique pur (parfois appelé acide acétique concentré) est venu à être connu sous le nom d’acide acétique glacial, un nom qui survit à ce jour.
Le troisième homologue, l’acide propionique (CH3CH2COOH), est rarement rencontré dans la vie quotidienne. Le quatrième homologue, l’acide butyrique (CH3CH2CH2COOH), est l’une des substances les plus malodorantes que l’on puisse imaginer. On le trouve dans le beurre rance et c’est l’un des ingrédients des odeurs corporelles. En reconnaissant des quantités extrêmement faibles de cette substance et d’autres produits chimiques, les limiers sont capables de suivre les fugitifs. Les modèles des quatre premiers acides carboxyliques sont représentés sur la figure \(\PageIndex{2}\).
L’acide dont le groupe carboxyle est attaché directement à un cycle benzénique est appelé acide benzoïque (C6H5COOH).

Les noms communs des acides carboxyliques utilisent des lettres grecques (α, β, γ, δ, et ainsi de suite), et non des chiffres, pour désigner la position des groupes substituants dans les acides. Ces lettres font référence à la position de l’atome de carbone par rapport à l’atome de carbone carboxylique.
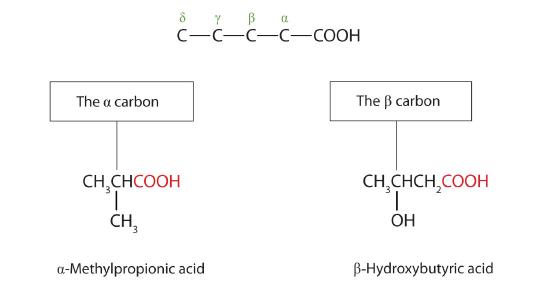
Dans le système de nomenclature de l’Union internationale de chimie pure et appliquée (UICPA), l’hydrocarbure parent est celui qui correspond à la plus longue chaîne continue (LCC) contenant le groupe carboxyle. La terminaison -e de l’alcane parent est remplacée par le suffixe -oïque et le mot acide. Par exemple, l’acide carboxylique dérivé du pentane est l’acide pentanoïque (CH3CH2CH2CH2COOH). Comme pour les aldéhydes, l’atome de carbone carboxylique est compté en premier ; les chiffres sont utilisés pour indiquer tout atome de carbone substitué dans la chaîne mère.
Les lettres grecques sont utilisées avec les noms communs ; les chiffres sont utilisés avec les noms UICPA.
Exemple \(\PageIndex{1}\)
Donnez les noms communs et UICPA de chaque composé.
- ClCH2CH2CH2COOH
-
Solution
- Le LCC contient quatre atomes de carbone ; le composé est donc nommé acide butyrique (ou butanoïque) substitué.
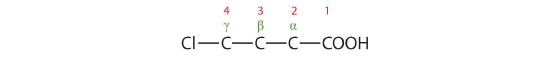
L’atome de chlore est attaché au carbone γ dans le système commun ou C4 dans le système IUPAC. Le composé est l’acide γ-chlorobutyrique ou l’acide 4-chlorobutanoïque.
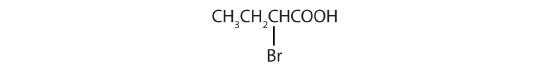
- Le LCC contient quatre atomes de carbone ; le composé est donc nommé comme un acide butyrique (ou butanoïque) substitué.
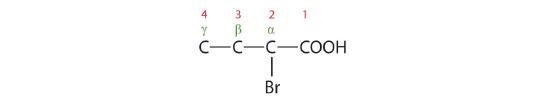
L’atome de brome (Br) se trouve sur le carbone α dans le système commun ou C2 dans le système IUPAC. Le composé est l’acide α-bromobutyrique ou l’acide 2-bromobutanoïque.
Exercice \(\PageIndex{1}\)
Donnez le nom IUPAC de chaque composé.
- ClCH2CH2CH2CH2COOH
- (CH3)2CHCH2CHBrCOOH
Exercice \(\PageIndex{2}\)
Écrivez la formule développée condensée de l’acide β-chloropropionique.
Solution
L’acide propionique possède trois atomes de carbone : C-C-COOH. Fixez un atome de chlore (Cl) à la chaîne mère au niveau de l’atome de carbone bêta, le deuxième à partir du groupe carboxyle : Cl-C-C-COOH. Ajoutez ensuite suffisamment d’atomes d’hydrogène pour donner à chaque atome de carbone quatre liaisons : ClCH2CH2COOH.
Exercice \(\PageIndex{2}\)
Écrivez la formule développée condensée de l’acide 4-bromo-5-méthylhexanoïque.
Exercices de révision des concepts
- Quel est le nom UICPA de l’acide carboxylique à chaîne droite comportant six atomes de carbone ?
- L’aldéhyde à chaîne droite comportant cinq atomes de carbone porte le nom commun de valéraldéhyde. Quel est le nom commun de l’acide carboxylique à chaîne droite correspondant ?
Réponses
- acide hexanoïque
- acide valérique
Clé. Takeaways
- Les acides carboxyliques simples sont mieux connus par des noms communs basés sur des mots latins et grecs qui décrivent leur source (par ex.g., acide formique, latin formica, signifiant » fourmi « ).
- Des lettres grecques, et non des chiffres, désignent la position des acides substitués dans la convention de dénomination commune.
- Les noms UICPA sont dérivés du LCC de l’hydrocarbure parent, la terminaison -e de l’alcane parent étant remplacée par le suffixe -oïque et le mot acide.
Exercices
-
Dessinez la structure de chaque composé.
- acide heptanoïque
- acide 3-méthylbutanoïque
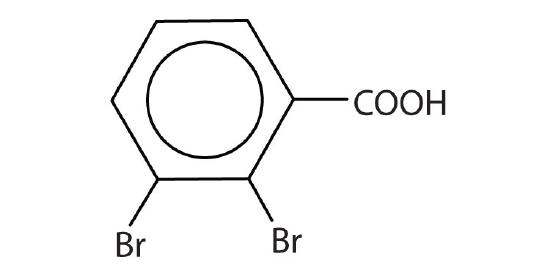
- acide 2,3-dibromobenzoïque
- acideβ-hydroxybutyrique
-
Dessinez la structure de chaque composé.
- Acide o-nitrobenzoïque
- Acide p-chlorobenzoïque
- Acide 3-chloropentanoïque
- Acideα-chloropropionique
-
Nommer chaque composé avec soit le nom IUPAC, le nom commun, ou les deux.
- (CH3)2CHCH2COOH
- (CH3)3CCH(CH3)CH2COOH
- CH2OHCH2CH2COOH
-
Nommer chaque composé avec son nom IUPAC.
- CH3(CH2)8COOH
- (CH3)2CHCCl2CH2CH2COOH
- CH3CHOHCH(CH2CH3)CHICOOH
Réponses
-
- CH3CH2CH2CH2CH2CH2CH2COOH
-
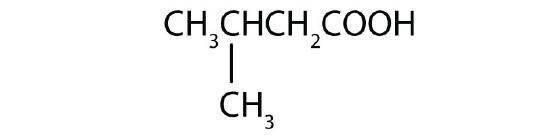
-
-
- 3-acide méthylbutanoïque ; Acide β-méthylbutyrique
- Acide 3,4,4-triméthylpentanoïque
- Acide 4-hydroxybutanoïque ; acide γ- hydroxybutyrique
.
.