Objectif d’apprentissage
- reconnaître les relations entre les isomères constitutionnels (structurels), les isomères de conformation et les isomères géométriques
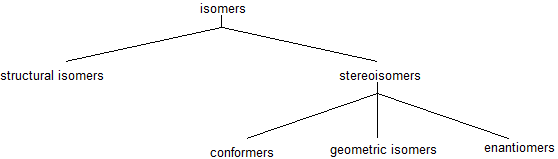
Isomères
Les isomères ont toujours la même formule chimique. Lorsque les formules chimiques sont différentes, alors les composés sont complètement différents. Des informations importantes peuvent être obtenues à partir des formules chimiques lors de la comparaison des composés.
Les isomères structurels (constitutionnels) ont la même formule moléculaire mais un arrangement de liaison différent entre les atomes. Les stéréoisomères ont des formules moléculaires et des arrangements d’atomes identiques. Ils ne diffèrent les uns des autres que par l’orientation spatiale des groupes dans la molécule. En chimie organique, il existe plusieurs types de stéréoisomères : les énantiomères, les diastéréoisomères, les isomères géométriques et les conformères. Ces stéréoisomères seront présentés et expliqués tout au long de plusieurs chapitres.
Isomères structurels (constitutionnels)
Parce que le carbone forme quatre liaisons, il peut y avoir plusieurs façons de former des molécules qui suivent la règle de l’octuple. Même avec seulement quatre atomes de carbone, il existe deux structures possibles pour le squelette de carbone. Les atomes de carbone peuvent être liés pour former une chaîne de quatre atomes de carbone (butane) ou il peut y avoir une branche d’un atome de carbone à partir d’une chaîne de trois atomes de carbone (2-méthylpropane). Le butane et le 2-méthylpropane sont des isomères structurels car ils ont tous deux la formule chimique C4H10.

Identique vs conforme
La rotation autour des liaisons simples crée des molécules dynamiques. Lorsque l’on dessine et que l’on discute de molécules, il est important d’être conscient que notre dessin est statique alors que la molécule elle-même est en rotation. Bien qu’il y ait sept liaisons sigma dans la molécule d’éthane, la rotation autour des six liaisons carbone-hydrogène n’entraîne aucun changement dans la forme de la molécule car les atomes d’hydrogène sont essentiellement sphériques. En revanche, la rotation autour de la liaison carbone-carbone donne lieu à de nombreuses conformations moléculaires différentes. Les conformères sont l’exemple le plus simple de stéréoisomérie.
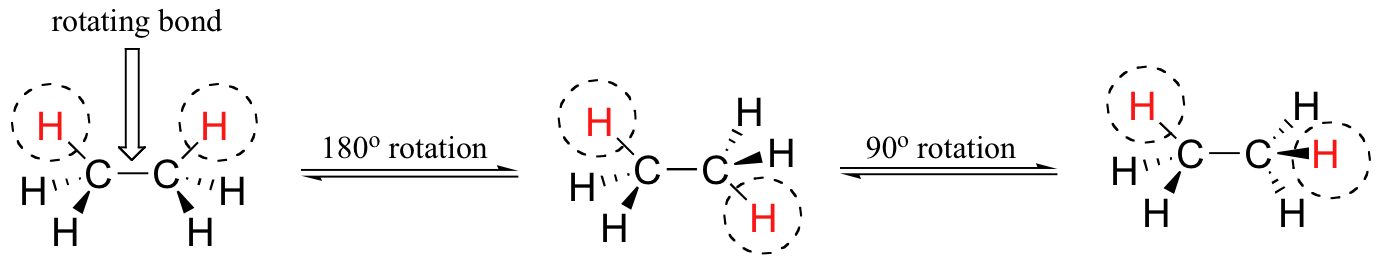
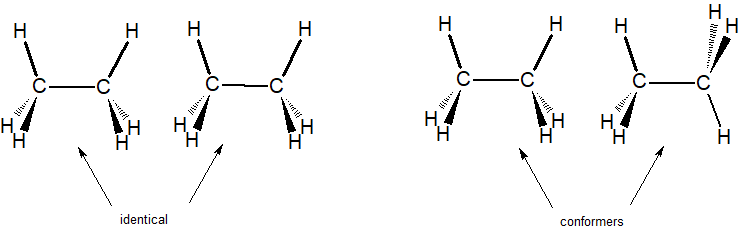
Les composés identiques sont le même composé représenté avec TOUS les atomes dans la même orientation spatiale.
Les conformères sont le même composé représenté avec différentes rotations autour des liaisons simples.
Dans l’exemple ci-dessous, nous pouvons comparer deux structures identiques pour l’éthane avec deux conformères de l’éthane.
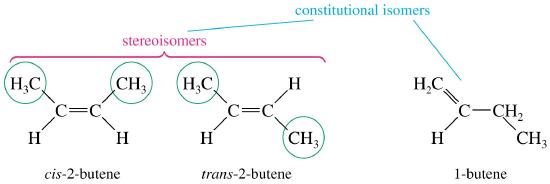
Isomères géométriques – un exemple de stéréoisomérie
La rigidité des liaisons pi dans les doubles liaisons peut créer un isomérisme géométrique. Sans rotation, il existe deux orientations différentes possibles à travers la double liaison carbone-carbone (C=C). La rigidité de la double liaison crée une ligne de référence pour l’orientation spatiale. Les préfixes cis et trans sont utilisés pour distinguer les isomères géométriques. Le stéréo-isomère cis a les deux atomes non hydrogène du même côté de la double liaison. Alors que le stéréo-isomère trans a les atomes non-hydrogène de l’autre côté de la double liaison. De la même manière, nous traversons l’océan lors d’un voyage transatlantique. Cette petite différence peut sembler insignifiante, mais les isomères géométriques sont des composés chimiques différents avec des propriétés physiques différentes comme le montre l’exemple ci-dessous.

Pour l’instant, il est important de distinguer les différences structurelles et les différences spatiales lors de la comparaison des composés. À l’avenir, nous examinerons de plus près l’isomérie.
Exemple
Regardons les structures de la ligne de liaison ci-dessous et déterminons les relations entre les paires de composés suivantes : identiques, conformères, isomères structurels, isomères géométriques ou composés complètement différents.
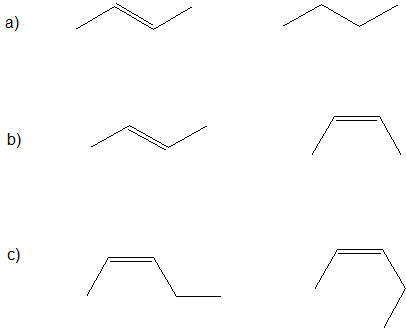
La première étape importante (qui est souvent sautée) consiste à déterminer la formule chimique de chaque composé. Si les formules chimiques sont différentes, alors les composés sont complètement différents et il n’y a PAS de relation isomérique. Si les formules chimiques sont identiques, nous identifions alors la différence entre les composés pour déterminer leur relation. S’il existe des différences structurelles dans les schémas de liaison, alors les composés sont constitutionnels (isomères structurels). Si les composés ont les mêmes liaisons structurelles, mais que les orientations spatiales sont différentes, alors les composés sont des stéréoisomères. Pour l’instant, les stéréoisomères possibles sont des conformères montrant le même composé avec des rotations de liaisons simples carbone-carbone différentes ou des isomères géométriques de composés avec des orientations différentes au niveau des doubles liaisons carbone-carbone.
En appliquant la logique ci-dessus à notre exemple, nous déterminons ce qui suit.
Exercice
1. Quelle est la relation entre les paires de composés suivantes : identiques, conformères, isomères structurels, isomères géométriques ou composés complètement différents ?
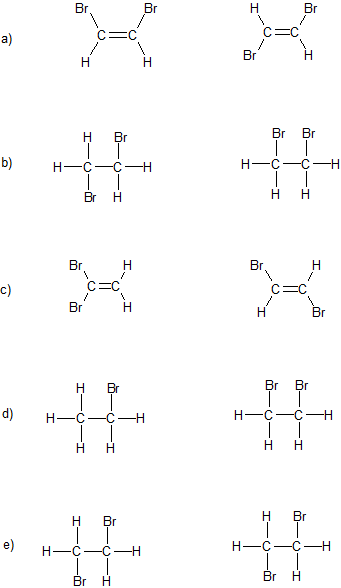
Réponse
a) isomères géométriques
b) conformères
c) isomères structuraux
d) composés complètement différents
e) identiques
.