Estérification
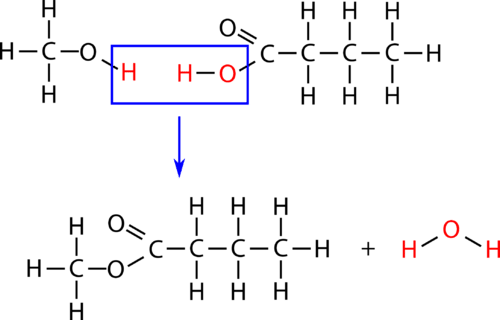
Une estérification est une réaction de condensation dans laquelle un ester est formé à partir d’un alcool et d’un acide carboxylique. L’estérification est une sous-catégorie des réactions de condensation car une molécule d’eau est produite dans la réaction. La réaction est catalysée par un acide fort, généralement l’acide sulfurique. Lorsque l’acide carboxylique butanoïque est chauffé avec un excès de méthanol et quelques gouttes d’acide sulfurique, l’ester butanoate de méthyle est produit. Le butanoate de méthyle a une odeur d’ananas. La réaction est présentée ci-dessous avec les formules moléculaires et structurelles.
La réaction d’estérification est réversible. Lorsqu’un ester est chauffé en présence d’une base forte comme l’hydroxyde de sodium, l’ester se décompose. Les produits sont un alcool et la base conjuguée de l’acide carboxylique sous forme de sel.
L’hydroxyde de sodium n’agit pas comme un catalyseur, mais est consommé dans la réaction.
La saponification décrit la réaction d’hydrolyse alcaline d’un ester. Le terme saponification décrivait à l’origine l’hydrolyse d’esters à longue chaîne appelés esters d’acides gras pour produire des molécules de savon, qui sont les sels des acides gras. L’une de ces molécules de savon est le stéarate de sodium, formé par l’hydrolyse du stéarate d’éthyle.
.