Objectifs d’apprentissage
Après avoir terminé cette section, vous devriez être en mesure de
-
- écrire une équation pour représenter la formation d’un savon.
- identifier la structure de la graisse nécessaire pour produire un savon donné.
- identifier la structure d’un savon, étant donné la structure de la graisse à partir de laquelle il est produit.
- Décrire le mécanisme par lequel les savons exercent leur action nettoyante.
- donner une explication chimique des problèmes rencontrés lors de l’utilisation des savons carboxylates dans les zones à eau dure, et expliquer comment ils peuvent être surmontés par l’utilisation de détergents sulfonates.
Termes clés
Veuillez vous assurer que vous pouvez définir, et utiliser en contexte, les termes clés ci-dessous.
- hydrophile
- lipophile (hydrophobe)
- amphiphile
- micelles
Les acides carboxyliques et les sels ayant des chaînes alkyle de plus de huit carbones présentent un comportement inhabituel dans l’eau en raison de la présence de régions hydrophiles (CO2) et hydrophobes (alkyle) dans la même molécule. Ces molécules sont dites amphiphiles (Gk. amphi = les deux) ou amphipathiques. Les acides gras composés de dix atomes de carbone ou plus sont pratiquement insolubles dans l’eau et, en raison de leur faible densité, flottent à la surface lorsqu’ils sont mélangés à l’eau. Contrairement à la paraffine ou à d’autres alcanes, qui ont tendance à former des flaques à la surface de l’eau, ces acides gras s’étalent uniformément sur une surface d’eau étendue, formant finalement une couche monomoléculaire dans laquelle les groupes carboxyle polaires sont liés par l’hydrogène à l’interface de l’eau, et les chaînes d’hydrocarbures sont alignées ensemble loin de l’eau. Ce comportement est illustré dans le diagramme de droite. Les substances qui s’accumulent à la surface de l’eau et modifient les propriétés de la surface sont appelées surfactants.
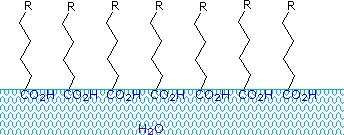
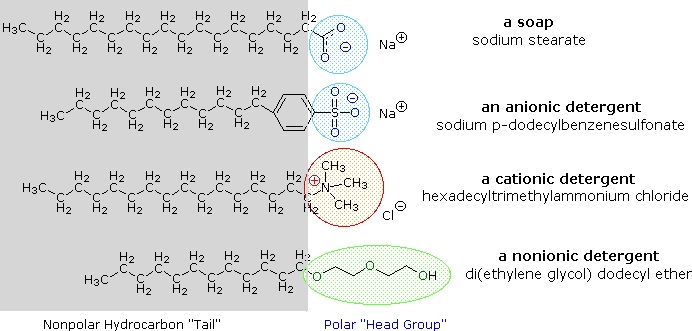
Les sels de métaux alcalins d’acides gras sont plus solubles dans l’eau que les acides eux-mêmes, et le caractère amphiphile de ces substances en fait également de puissants surfactants. Les exemples les plus courants de ces composés sont les savons et les détergents, dont quatre sont présentés ci-dessous. Notez que chacune de ces molécules possède une chaîne hydrocarbonée non polaire, la « queue », et un « groupe de tête » polaire (souvent ionique). L’utilisation de ces composés comme agents nettoyants est facilitée par leur caractère tensioactif, qui abaisse la tension superficielle de l’eau, lui permettant de pénétrer et de mouiller une variété de matériaux.
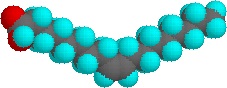
De très petites quantités de ces tensioactifs se dissolvent dans l’eau pour donner une dispersion aléatoire de molécules de soluté. Cependant, lorsque la concentration est augmentée, un changement intéressant se produit. Les molécules de tensioactifs s’assemblent de manière réversible en agrégats polymoléculaires appelés micelles. En rassemblant les chaînes hydrophobes au centre de la micelle, la perturbation de la structure de liaison hydrogène de l’eau liquide est minimisée, et les groupes polaires de tête s’étendent dans l’eau environnante où ils participent à la liaison hydrogène. Ces micelles sont souvent de forme sphérique, mais peuvent également prendre des formes cylindriques et ramifiées, comme illustré à droite. Ici, le groupe de tête polaire est désigné par un cercle bleu, et la queue non polaire est une ligne noire en zigzag.
Le plus ancien agent nettoyant amphiphile connu des humains est le savon. Le savon est fabriqué par l’hydrolyse catalysée par une base (saponification) de la graisse animale (voir ci-dessous). Avant que l’hydroxyde de sodium ne soit disponible dans le commerce, on utilisait une solution bouillante de carbonate de potassium lessivé des cendres de bois. Les savons de potassium mous étaient ensuite transformés en savons de sodium plus durs par lavage avec une solution saline. L’importance du savon pour la civilisation humaine est documentée par l’histoire, mais certains problèmes liés à son utilisation ont été reconnus. L’un d’eux est dû à la faible acidité (pKa environ 4,9) des acides gras. Les solutions de savons de métaux alcalins sont légèrement alcalines (pH 8 à 9) en raison de l’hydrolyse. Si le pH d’une solution de savon est abaissé par des contaminants acides, les acides gras insolubles précipitent et forment une écume. Un deuxième problème est causé par la présence de sels de calcium et de magnésium dans l’approvisionnement en eau (eau dure). Ces cations divalents provoquent l’agrégation des micelles, qui se déposent alors sous forme d’écume sale.
Ces problèmes ont été atténués par le développement d’amphiphiles synthétiques appelés détergents (ou syndets). En utilisant un acide beaucoup plus fort pour le groupe polaire de tête, les solutions aqueuses de l’amphiphile sont moins sensibles aux changements de pH. De même, les fonctions sulfonate utilisées pour la quasi-totalité des détergents anioniques confèrent une plus grande solubilité aux micelles incorporant les cations alcalino-terreux que l’on trouve dans les eaux dures. Des variations sur le thème des amphiphiles ont conduit au développement d’autres classes, telles que les détergents cationiques et non ioniques présentés ci-dessus. Les détergents cationiques présentent souvent des propriétés germicides, et leur capacité à modifier le pH des surfaces les a rendus utiles comme adoucisseurs de tissus et conditionneurs de cheveux. Ces » outils » chimiques polyvalents ont considérablement transformé les marchés des produits de nettoyage ménagers et de soins personnels au cours des cinquante dernières années
Réactions chimiques des graisses et des huiles
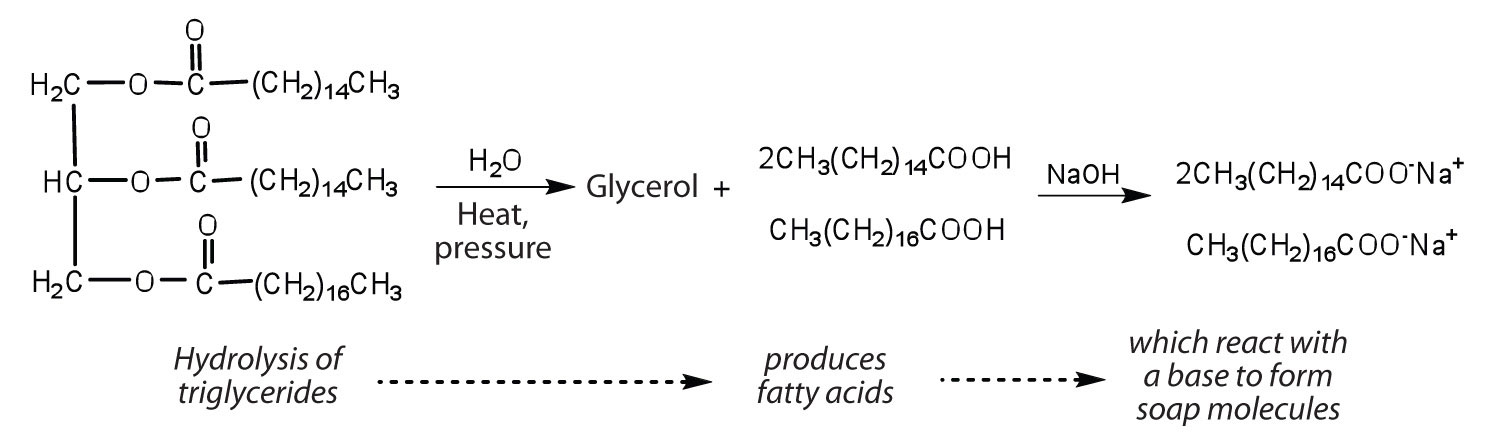
Les graisses et les huiles peuvent participer à une variété de réactions chimiques-par exemple, parce que les triglycérides sont des esters, ils peuvent être hydrolysés en présence d’un acide, d’une base ou d’enzymes spécifiques connues sous le nom de lipases. L’hydrolyse des graisses et des huiles en présence d’une base est utilisée pour fabriquer du savon et s’appelle la saponification. Aujourd’hui, la plupart des savons sont préparés par hydrolyse des triglycérides (souvent du suif, de l’huile de coco ou des deux) à l’aide d’eau sous haute pression et à haute température. Le carbonate de sodium ou l’hydroxyde de sodium est ensuite utilisé pour convertir les acides gras en leurs sels de sodium (molécules de savon) :
Contributeurs et attributions
-
Dr. Dietmar Kennepohl FCIC (professeur de chimie, Université Athabasca)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professeur émérite (Michigan State U.), Virtual Textbook of Organic Chemistry
- The Basics of General, Organic, and Biological Chemistry de David W. Ball, John W. Hill et Rhonda J. Scott.