Exercice
1. Montrez comment préparer le 3-méthyl2-pentanol à partir du 3-méthyl-1-pentène.
Note : Les questions 2 à 5 n’ont pas montré l’eau présente dans la solution d’acide sulfurique et ont indiqué une seconde étape de neutralisation. Certains auteurs écrivent simplement H+/H2O comme une seule étape.
2. Dessinez la structure de la ligne de liaison pour le produit.
.bmp?revision=1&size=bestfit&width=326&height=100)
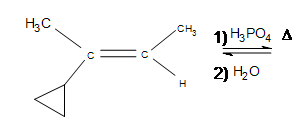
3. Dessinez la structure de la ligne de liaison pour le produit. Comment le groupe cyclopropane affecte-t-il la réaction ?
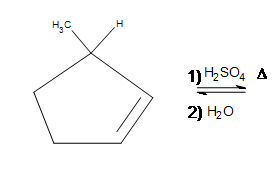
4. Dessinez la structure de liaison pour le produit. (Indice : qu’est-ce qui est différent dans ce problème ?)
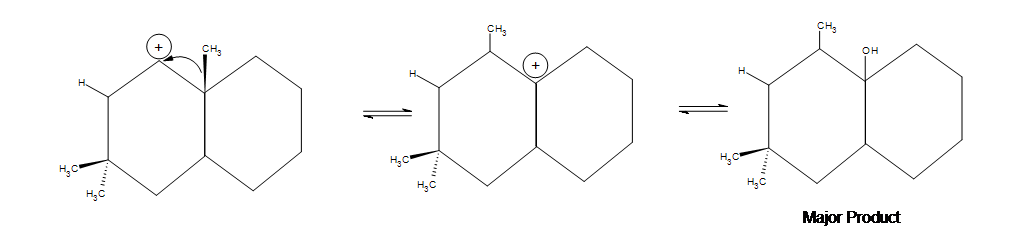
5. Dessinez la structure de la ligne de liaison pour le ou les produits. Indiquez les éventuels décalages ainsi que le produit principal :

6. Dans chaque cas, prédisez le ou les produits de ces réactifs d’oxymercuration.

7. Proposez l’alcène qui était le réactif pour chacun de ces produits d’oxymercuration.

Réponse
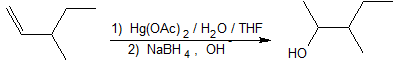
2. Cette réaction est une hydratation électrophile.
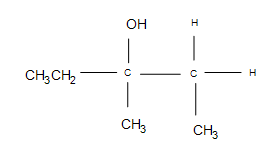
3. La réponse est des produits secondaires supplémentaires, mais le produit principal formé est toujours le même (le produit représenté). Selon les températures utilisées, le cyclopropane peut s’ouvrir en une chaîne droite, ce qui rend peu probable la formation du produit majeur (après la réaction, il est peu probable que le carbone 3º reste tel quel).
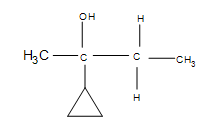
4. Un déplacement d’hydrure se produit effectivement du sommet du 1-méthylcyclopentane vers l’endroit où le carbocation s’était formé.
.bmp?revision=1&size=bestfit&width=290&height=201)
5. Dans la première image présentée ci-dessous, un déplacement d’alkyle se produit mais un déplacement d’hydrure (qui se produit plus rapidement) est possible. Pourquoi un déplacement d’hydrure ne se produit-il pas ? La réponse est que le déplacement d’alkyle conduit à un produit plus stable. Il y a une quantité notable de produit secondaire qui se forme là où se trouvent les deux groupes méthyles, mais le produit majeur montré ci-dessous reste le plus important en raison de l’hyperconjugaison qui se produit en étant entre les deux cyclohexanes.