1. Morphologie
2. Fonctions
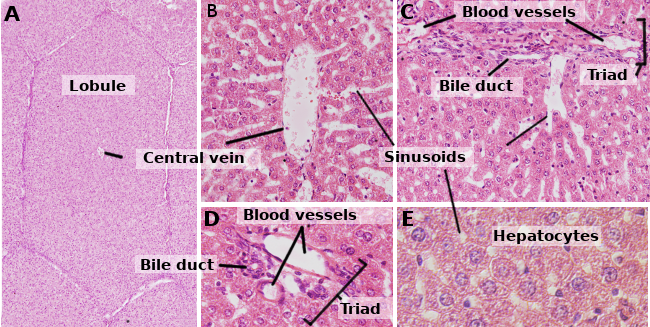
Les hépatocytes sont les cellules du foie, représentant environ 80 % de cet organe. Ils sont organisés en feuillets d’environ une cellule d’épaisseur. Les feuillets sont reliés entre eux formant une structure de type spongieux (figures 1 et 2). Les hépatocytes sont des cellules à vie plutôt longue, se renouvelant environ tous les 5 mois. Cependant, cela peut changer dans le cadre de processus régénératifs où les hépatocytes montrent une grande capacité de prolifération et de régénération des tissus hépatiques endommagés.

Morphologie
Les hépatocytes sont des cellules polyédriques, c’est-à-dire qu’elles ont plusieurs faces. Ils présentent généralement 6 faces, mais ce nombre peut varier. Les faces sont en contact soit avec un autre hépatocyte, soit avec un sinusoïde (figure 3). Les hépatocytes sont de grandes cellules, d’environ 20 à 30 µm de diamètre. Ils présentent un noyau rond centré dans le cytoplasme. Cependant, dans le foie de l’homme adulte, jusqu’à 25 % des hépatocytes peuvent être binucléés (Figure 2). La majorité des noyaux sont tétraploïdes, c’est-à-dire qu’ils contiennent une quantité d’ADN double de celle d’une cellule ordinaire. La taille des noyaux est variable, bien qu’ils soient plus grands dans les cellules tétraploïdes. Les noyaux présentent une hétérochromatine dispersée et un ou plusieurs nucléoles. Il n’est pas courant d’observer des hépatocytes mitotiques (1 pour 10000 ou 20000 hépatocytes) dans des conditions normales. Cependant, les hépatocytes mitotiques augmentent énormément lors de lésions hépatiques et de processus de régénération. Les caractéristiques du cytoplasme varient en fonction de l’état physiologique de la cellule, principalement influencé par les dépôts de graisse et de glycogène. Il y a beaucoup de petites mitochondries, 800 à 100 par hépatocyte. On estime qu’un hépatocyte peut contenir environ 50 appareils de Golgi qui sont généralement organisés en piles de 3 à 5 citernes présentant des régions latérales épaissies contenant des corps sombres. Les piles de citernes sont en quelque sorte dispersées dans le cytoplasme, bien qu’elles soient souvent observées près des canalicules biliaires (Figures 3 et 4). Les hépatocytes contiennent de nombreux peroxysomes (200 à 300), plus que les autres cellules régulières. Près des canalicules ciliaires, on trouve également de nombreux lysosomes.


On trouve des dépôts abondants de glycogène et de lipides dans le cytoplasme des hépatocytes (l’aspect granuleux des hépatocytes après coloration à l’hématoxyline et à l’éosine est dû aux trous laissés par l’extraction des lipides du cytoplasme pendant le traitement des tissus). Dans le cytoplasme, on trouve également des corps résiduels contenant de la lipofuscine. Le réticulum endoplasmique lisse est assez abondant, bien que la taille de l’organite varie selon l’activité métabolique de l’hépatocyte. Il est concentré autour des dépôts de glycogène. Dans les lobules du foie, on observe des différences morphologiques en comparant les hépatocytes périphériques et centraux, principalement influencées par les caractéristiques du sang. Par exemple, après la digestion, les hépatocytes périphériques sont les premiers à stocker le glycogène, mais les derniers à le mobiliser lorsque le reste du corps en a besoin. En revanche, le stockage des graisses se fait d’abord dans les hépatocytes situés au centre, qui ont généralement un réticulum endoplasmique plus lisse. En revanche, le réticulum endoplasmique rugueux présente 50 % de surface en plus dans les hépatocytes situés en périphérie et en milieu de cercle que dans ceux de la partie interne du lobule hépatique.
Contrairement aux autres cellules épithéliales, les hépatocytes ne sont pas liés à une membrane basale. Leurs membranes basolatérales sont entourées d’une matrice extracellulaire de faible densité synthétisée par les hépatocytes eux-mêmes. Elle facilite la diffusion et l’échange de molécules avec les sinusoïdes à travers l’espace de Disse, ou espaces périsinousoïdaux, qui est l’espace entre l’endothélium fenestré et les hépatocytes. Cette matrice extracellulaire est dépourvue de laminine, du moins lorsque l’hépatocyte est différencié. Cependant, le collagène de type IV et la fibronectine semblent nécessaires à une bonne différenciation des hépatocytes. Les hépatocytes sont connectés entre eux par des jonctions gap, des jonctions adhérentes, des desmosomes et des jonctions serrées.
Les hépatocytes sont des cellules polarisées, c’est-à-dire qu’il existe des différences entre les régions faisant face aux canalicules biliaires et les régions proches des sinusoïdes. La polarité est essentielle pour le bon fonctionnement de l’hépatocyte, et elle est désorganisée dans de nombreuses pathologies hépatiques. La région apicale est en contact avec les canalicules biliaires. Comme dans le domaine apical des cellules épithéliales, il existe des jonctions serrées, qui scellent et maintiennent l’intégrité des canaux biliaires. La membrane apicale se replie en microvillosités qui augmentent énormément la surface de la membrane. La membrane apicale représente environ 13 % de la membrane totale de l’hépatocyte, et elle est capable de contenir une grande quantité de molécules. La suppression des jonctions serrées entraîne la désorganisation de la polarité cellulaire. La polarité des hépatocytes et les canalicules biliaires sont établis pendant la période de développement de l’embryon.
La polarité fonctionnelle repose sur une répartition inégale des transporteurs et autres molécules membranaires entre les domaines apical et baso-latéral de la membrane plasmique. Les transporteurs ABC (cassettes de liaison à l’ATP) sont parmi les transporteurs apicaux les plus importants dans les hépatocytes. L’appareil de Golgi, les endosomes et le cytosquelette (microtubules et filaments d’actine) sont responsables de la distribution différentielle des molécules entre les deux domaines membranaires. Il existe deux voies d’acheminement des protéines vers le domaine apical (figure 5) : à partir de l’appareil de Golgi, les protéines (par exemple, les transporteurs ABC) sont libérées dans des vésicules vers la membrane plasmique apicale ou vers les endosomes de recyclage, qui fonctionnent comme des intermédiaires. D’autres protéines suivent une voie de transcytose, voyageant d’abord vers les membranes basolatérales, puis elles sont enfermées dans des vésicules d’endocytose vers les endosomes, où elles sont à nouveau emballées dans des vésicules et expédiées vers la membrane apicale. Plus rare est une voie impliquant l’exocytose des lysosomes, suivie par des transporteurs cooper.

Fonctions
La fonction principale des hépatocytes est de métaboliser les substances issues de la digestion. Le foie est irrigué par la veine porte qui a rassemblé les molécules issues de la digestion dans l’intestin. Les hépatocytes sont également fortement impliqués dans la détoxification des molécules potentiellement dangereuses. D’autre part, les hépatocytes synthétisent la bile, qui est finalement libérée dans l’intestin et aide à la digestion. Pour ces deux fonctions, métaboliser les molécules issues de la digestion et libérer la bile, les hépatocytes sont placés à un endroit privilégié : au contact des sinusoïdes, qui apportent à l’intestin les molécules digérées, et forment les canalicules biliaires qui drainent la bile des lobules du foie.
Glucose. Les hépatocytes vont chercher les molécules de glucose provenant de la digestion et les stockent sous forme de glycogène, qui est mobilisé lorsque l’organisme a besoin d’énergie. Le glycogène se trouve généralement près du réticulum endoplasmique car l’enzyme glucose-6-phosphatase est située dans cet organite. La glucose-6-phosphatase catalyse le glucose-6-phosphate, la forme moléculaire du glucose après le catabolisme du glycogène, et produit du glucose libre, qui peut sortir de l’hépatocyte et atteindre la circulation sanguine.
Synthèse de molécules . Les sels biliaires, qui aident à la digestion des graisses, sont une des substances synthétisées par les hépatocytes. Dans le réticulum endoplasmique lisse, on trouve de nombreuses enzymes qui participent à la synthèse du cholestérol et d’autres lipides. En outre, les hépatocytes produisent les lipoprotéines nécessaires au transport des lipides dans la circulation sanguine. Le fibrinogène pour la coagulation du sang et les albumines plasmatiques sont également synthétisés par les hépatocytes. Dans le foie, l’urée est produite comme sous-produit de la dégradation des protéines. La production et l’accumulation d’une grande quantité d’urée dans l’organisme peuvent être nuisibles. Les hépatocytes stockent les vitamines A et B, ainsi que l’héparine.
Métabolisme lipidique. La bêta-oxydation, impliquée dans le catabolisme lipidique, fonctionne dans les peroxysomes abondants des hépatocytes.
Détoxification. Les hépatocytes recueillent les substances nutritives issues de la digestion, mais ils sont aussi les premiers à recevoir des substances potentiellement toxiques. L’éthanol des boissons alcoolisées est principalement dégradé dans le foie, en fait dans les nombreux peroxysomes des hépatocytes. La moitié de l’alcool ingéré est transformée en acétaldéhyde dans ces organites. Il existe des enzymes dans le réticulum endoplasmique lisse qui participent à la dégradation ou à l’inactivation des toxines et des médicaments. Pendant les périodes de forte demande d’élimination des substances toxiques, comme pendant les traitements médicamenteux ou la consommation continue d’alcool, le réticulum endoplasmique peut devenir l’organite le plus volumineux de l’hépatocyte. Les médicaments sont généralement inactivés par conjugaison avec d’autres molécules. Par exemple, la glucosyltransférase conjugue les molécules avec les barbituriques.
Stockage et régulation du fer. Les hépatocytes peuvent fonctionner pour stocker le fer, qui est concentré dans des dépôts cytoplasmiques liés à la ferritine. Les hépatocytes peuvent capter le fer de plusieurs façons : lié à la transferrine, faisant partie de groupes hémiques et de groupes non hémiques. Le fer de la transferrine entre dans la cellule par endocytose médiée par le récepteur TRF1. Lorsque les vésicules endocytiques fusionnent avec les endosomes, la transferrine libère du Fe3+, qui est transformé en F2+ et extrudé vers le cytosol par le transporteur DMT1 (divalent metal transporter 1). Les molécules d’hème-fer sont également endocytées et sont transloquées vers le cytosol à travers la membrane endosomale par le transporteur HRG1. Cependant, la majorité du fer entre depuis l’espace extracellulaire par le transporteur ZIP14 placé dans la membrane plasmique de l’hépatocyte en face des sinusoïdes. Une fois dans le cytosol, le fer est lié à la ferritine et stocké dans le cytoplasme car le fer libre est toxique. La libération du fer de l’entérocyte est médiée par le transporteur ferroportine présent dans la membrane plasmique près des sinusoïdes.
Après la moelle osseuse, le foie est le deuxième grand centre de production de groupes hémiques. Le groupe hème est un groupe prosthétique (non peptidique) présent dans plusieurs protéines de transport de l’oxygène, dans ces enzymes comme les catalases et les peroxydases qui protègent contre les substances oxydantes. Il fait également partie des cytochromes mitochondriaux et peroxysomaux. La plus grande quantité de groupes hémiques se trouve dans l’hémoglobine, qui est synthétisée dans la moelle osseuse. Dans le foie, la synthèse des groupes hémiques dépend de la quantité de cytochrome p450 microsomal nécessaire à la cellule, de sorte que la plupart de ces groupes hémiques font partie des cytochromes p450.
Les hépatocytes libèrent l’hormone hepcidine, qui régule la concentration systémique en fer dans l’organisme. Cette hormone contrôle la quantité de fer dans le plasma en favorisant l’internalisation et la dégradation de la ferroportine, transporteur de fer présent dans les entérocytes, les macrophages et les hapatocytes. L’élimination de la ferroportine inhibe la libération du fer par ces cellules. La synthèse de l’hépcidine est régulée par la concentration en fer de la transferrine dans le plasma, par les dépôts de fer dans les hépatocytes et par l’inflammation. L’activité érythropoïétique inhibe la libération de l’hepcidine.
Bibliographie
Gissen P, Arias IM. 2015. Polarité structurelle et fonctionnelle des hépatocytes et maladies du foie. Journal of hepatholoty. 63 : 1023-1037.
Knutson MD. 2014. Cellules souches intestinales adultes : moteurs critiques de l’homéostasie et de la régénération épithéliales. Revue de la nature en biologie cellulaire moléculaire. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelone.