Question directrice
Quels facteurs déterminent l’exactitude et la précision de la concentration d’acide acétique dans le vinaigre ?
Introduction
De nombreux laboratoires analysent des produits de consommation pour déterminer l’exactitude de l’étiquetage du produit. La technique très courante et simple du titrage est démontrée dans cette expérience. Un titrage est une procédure analytique dans laquelle une réaction est effectuée dans des conditions soigneusement contrôlées. Le volume stœchiométrique d’un réactif de concentration connue, le titrant, qui est nécessaire pour réagir avec un autre réactif de concentration inconnue, l’analyte, est mesuré. La concentration de l’analyte est déterminée à partir de la concentration et du volume du réactif titrant et de la stœchiométrie de la réaction entre eux. Le montage expérimental est illustré à la figure 1. Une burette, qui contient le réactif de titrage, est étalonnée afin que le volume de solution qu’elle délivre puisse être déterminé avec une grande exactitude et une grande précision. Le réactif titrant est ajouté à l’analyte jusqu’à ce que le volume stœchiométrique de réactif titrant ait été ajouté. C’est ce qu’on appelle le point d’équivalence, auquel on lit le volume de titrant délivré par la burette. Habituellement, les lectures de volume sont estimées à 0,01 ml près. La distribution du titrant est ajustée à l’aide du robinet de la burette. Avec de la pratique, on peut distribuer des fractions d’une goutte de réactif titrant et contrôler la procédure suffisamment bien pour que les titrages répétés concordent à 0,10 ml près. Pour ce premier laboratoire, vous aurez besoin que vos titrages concordent à 0,50 mL près.
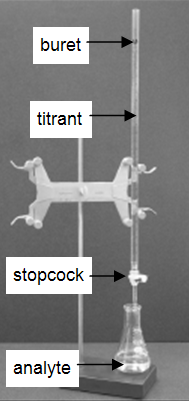
Figure 1 : Montage du titrage
Souvent, le point d’équivalence est déterminé visuellement avec un indicateur. L’indicateur, qui est une substance qui change de couleur près du point d’équivalence, est ajouté à la solution de l’analyte. Comme le changement de couleur est proche du point d’équivalence, mais pas exactement, le point auquel le changement de couleur se produit est appelé point final. Les indicateurs sont choisis de manière à ce que le point final soit très proche du point d’équivalence. Il est important de maintenir un titrage bien mélangé, afin que le titrant et l’analyte puissent entrer en contact et réagir rapidement. Il est possible de remuer manuellement le ballon ou de le remuer mécaniquement. Vous utiliserez l’agitation manuelle dans cette expérience. N’oubliez pas de remuer constamment pour assurer un mélange complet des solutions. Le type de titrage le plus courant est le titrage acide-base. Dans cette expérience, vous allez déterminer la concentration d’acide acétique, HC2H3O2, dans un vinaigre commercial. Dans ce titrage, le NaOH aqueux est le titrant et le vinaigre est l’analyte. Nous supposons que la base forte et l’acide faible réagissent complètement selon l’équation nette :
L’équation équilibrée montre une stœchiométrie 1:1, on peut donc écrire :
Ou plus généralement :
Les moles de base peuvent être calculées à partir de la molarité fois le volume
0.100 mmol NaOH
1 mol de solution
= 1,02 mmol NaOH
La molarité de l’acide peut être calculée à partir des moles divisées par le volume
Dans cette expérience, un volume soigneusement mesuré de vinaigre
est placé dans un flacon et la masse est déterminée. On titre ensuite l’échantillon de vinaigre avec une solution de NaOH de concentration connue
et on détermine le volume de solution de NaOH nécessaire pour atteindre le point final
.
et
sont tous connus, de sorte que la concentration de l’acide
peut être déterminée comme décrit ci-dessus. En outre, la masse d’acide acétique dans l’échantillon peut être déterminée à partir du nombre de moles présentes et de la masse molaire de l’acide acétique
Enfin, le pourcentage massique d’acide acétique dans le vinaigre peut être déterminé à partir de la masse de l’acide acétique dans l’échantillon et de la masse de la solution de vinaigre qui a été titrée.
masse d’acide acétique dans l’échantillon
masse de la solution de vinaigre titrée
× 100
Dans le titrage de l’acide acétique avec du NaOH aqueux, la phénolphtaléine est utilisée comme indicateur. La phénolphtaléine est presque incolore en solution acide mais devient rose à un pH d’environ 8, ce qui indique que la base a neutralisé tout l’acide. En titrant le vinaigre, vous observerez que la couleur rose est plus persistante à mesure que vous ajoutez de la base. C’est le signal qu’il faut ralentir l’addition de la base, et la contrôler soigneusement. Le point final a été atteint lorsqu’une faible couleur rose persiste pendant au moins 30 secondes. Il est facile de dépasser le point final. Si cela se produit, vous obtiendrez une solution rose violet foncé et vous devrez répéter le titrage, alors soyez prudent. Notez le volume que vous avez utilisé, arrêtez-vous à ce volume lors des titrages suivants et ajoutez le dernier millilitre au compte-gouttes. Votre instructeur vous montrera comment contrôler le robinet de la burette pour faciliter cette opération. Notez que les mesures de volume dans les titrages sont généralement rapportées à quatre chiffres significatifs, donc les concentrations sont également rapportées à quatre chiffres significatifs. Faites attention à cela dans votre travail ; lorsque vous calculez les masses molaires, assurez-vous d’avoir quatre chiffres significatifs.
Buts
En réalisant cette enquête, vous allez :
-
1
Normaliser une solution de NaOH(aq).
-
3
Mesurer la densité d’un échantillon de vinaigre.
Titrer un échantillon de vinaigre avec la solution normalisée de NaOH(aq).
Calculer la molarité et le pourcentage massique d’acide acétique dans l’échantillon de vinaigre.
Matériel disponible pour l’utilisation
- Vinaigre
- Solution de NaOH(aq)
- KHP – hydrogénophtalate de potassium
- Indicateur de phénolphtaléine
- Pipettes de 10 mL
- Béchers
- Flacons Erlenmeyer, 125 mL
- Porte-burette avec burette
- Entonnoir
- Balances analytiques
Précautions de sécurité
NaOH est corrosif. Il peut attaquer la peau et causer des dommages permanents aux yeux. Si la solution de NaOH vous éclabousse les yeux, utilisez immédiatement la station de lavage oculaire. Maintenez vos yeux ouverts et rincez-les avec de l’eau. En cas de contact avec la peau ou les vêtements, rincez la zone affectée avec de l’eau. Demandez à votre partenaire de laboratoire d’informer votre instructeur du déversement.
Mise en route
Votre première tâche consiste à normaliser la solution de NaOH en utilisant le KHP solide (KC8H5O4, 204,22 g/mol). Cela signifie que vous devez déterminer sa molarité avec au moins trois chiffres significatifs. Vous aurez besoin d’au moins trois titrages qui concordent à 1% près comme décrit dans la procédure. Vous avez deux autres tâches à accomplir dans ce laboratoire. Vous devez déterminer la densité de la solution de vinaigre et la molarité de l’acide acétique dans le vinaigre. Le pourcentage de masse de l’acide acétique peut être calculé à partir de vos données.Pour accomplir vos tâches, vous devrez effectuer des mesures de volume et de masse très précises. Les burettes et les pipettes sont utiles pour mesurer les volumes avec précision. La burette et la pipette sont décrites dans l’introduction et les vidéos. Avant de commencer, assurez-vous de comprendre leur utilisation correcte.
Procédure
Veuillez imprimer la feuille de travail pour ce laboratoire. Vous aurez besoin de cette feuille pour enregistrer vos données.

Préparation de la burette
Vérifiez la burette en rinçant les côtés avec une bouteille d’eau distillée pour vérifier si de l’eau » coule » à l’intérieur de la burette. Si des gouttelettes d’eau sont observées, la burette doit être lavée avant d’être utilisée. Veillez à ne pas rayer la surface intérieure si vous devez utiliser une brosse à burette pour la nettoyer. Rincez bien la burette à l’eau du robinet, y compris le robinet d’arrêt et les rondelles. Rincez ensuite les parois de la burette avec de l’eau déionisée/distillée.
Enfin, rincez la burette au moins DEUX fois avec de petites portions de votre solution de NaOH pour vous assurer que toute l’eau est éliminée. Faites sortir la solution par l’embout.
Remplissez la burette avec la solution de NaOH en utilisant un entonnoir.
Pour éliminer les bulles d’air piégées dans l’embout de la burette après le remplissage, ouvrez et fermez rapidement le robinet d’arrêt à plusieurs reprises. Remarque : si le robinet d’arrêt est correctement aligné avec l’embout de la burette, les bulles piégées ne sont pas aussi fréquentes. Vérifiez avec l’instructeur si la bulle persiste.
Normalisation avec le KHP
Utilisez ~1 gramme de KHP. ENREGISTREZ IMMÉDIATEMENT LA MASSE DANS LE TABLEAU DE DONNÉES.
Utilisez le flacon laveur d’eau distillée pour vous assurer que tous les échantillons ont été transférés dans le flacon.
Ajoutez environ 50 ml d’eau distillée et deux ou trois gouttes d’indicateur. L’indicateur phénolphtaléine sera utilisé dans cette expérience de titrage. N’utilisez pas trop d’indicateur, sinon vous devrez également titrer cette molécule. Soyez cohérent en utilisant le même nombre de gouttes dans tous les échantillons.
Technique de titrage
Placez une feuille de papier blanc sous le flacon récepteur pour observer plus facilement le point final.
Utiliser une carte fendue haut blanc/bas noir pour faciliter la lecture du ménisque. En plaçant la carte derrière la burette et la ligne noire juste en dessous du ménisque, on assombrit le ménisque pour faciliter la lecture. INSCRIVEZ LE VOLUME INITIAL DE LA SOLUTION DE NaOH AU Centième de millilitre près (±0,01 ml) DANS LE TABLEAU DES DONNÉES DE VOTRE CARNET.
Le titrant (solution de NaOH dans la burette) peut être ajouté assez rapidement au début, mais à mesure que l’on s’approche du point final, il faut ralentir le rythme d’ajout. Si vous êtes droitier, il est plus rapide d’ajouter le réactif de titrage avec votre main gauche tout en agitant avec votre main droite (vice versa pour les gauchers). À mesure que l’on s’approche du point final, la couleur rose persiste de plus en plus longtemps. À l’approche du point final, rincez les parois de la fiole avec de l’eau distillée pour vous assurer que toute la base NaOH ajoutée a réagi.
Lorsque l’on est très proche du point final, on suspend une demi goutte de base sur la pointe de la burette et on rince la goutte dans le flacon récepteur avec le flacon laveur d’eau distillée. Une autre méthode utilisée pour ajouter une fraction de goutte consiste à faire tourner le robinet d’arrêt de 180 degrés très rapidement ; cependant, vous pouvez ajouter par inadvertance trop de base si vous faites cette technique incorrectement.
Le point final se produit lorsque la phénolphtaléine passe de la couleur claire à la couleur rose la plus faible que vous pouvez voir et qu’elle persiste pendant un minimum de 30 secondes. INSCRIVEZ LE VOLUME FINAL DE LA SOLUTION DE NaOH AU Centième de millilitre près (±0,01 ml) DANS LE TABLEAU DES DONNÉES. Déterminez ensuite la quantité de solution de NaOH utilisée pour le titrage.
Votre groupe doit effectuer un MINIMUM de QUATRE ESSAIS et trois essais doivent concorder à ±1% près. Vous pouvez en fait en faire plus en fonction de votre technique. VOUS NE POUVEZ PAS SIMPLEMENT « RAYER » DES DONNÉES PARCE QU’ELLES NE VOUS PLAISENT PAS ; VOUS DEVEZ INDIQUER LA RAISON DE CE REJET. La raison peut être évidente, telle que « dépassement du point final », ou vous pouvez seulement être en mesure d’écarter la valeur en fonction des tests statistiques.
Molarité de l’acide acétique dans le vinaigre
Conditionner la burette avec du NaOH standardisé de la semaine précédente.
Conditionner une pipette de 10 ml avec la solution de vinaigre.
Mesurez 10 mL de vinaigre dans un flacon Erlenmeyer et ajoutez l’indicateur de phénolphtaléine.
Titrez avec le NaOH standard du laboratoire précédent.
Séance d’affichage interactive
Une fois que votre groupe a terminé son travail, préparez un tableau blanc que vous pourrez utiliser pour partager et justifier vos idées. Consultez le document fourni pour obtenir des détails sur ce processus.
Rapport
Une fois que vous aurez terminé vos recherches, vous devrez préparer un rapport d’enquête qui comprendra trois sections. Ce rapport peut nécessiter plus de deux pages avec des tableaux de données. Ce rapport doit être dactylographié et tous les diagrammes, figures ou tableaux doivent être intégrés dans le document.
- Section 1 : Quel concept et/ou technique avez-vous étudié, et comment se rapporte-t-il à la question directrice ? Quels facteurs déterminent l’exactitude et la précision de la détermination de la concentration d’acide acétique dans le vinaigre ? Décrivez le titrage et son utilisation en conjonction avec la stœchiométrie molaire pour déterminer la concentration.
- Section 2 : Comment avez-vous procédé et pourquoi avez-vous mené votre enquête de cette façon ? Plus précisément, quelles mesures avez-vous prises pour assurer l’exactitude et la précision ?
- Section 3 : L’argument de cette enquête ne porte pas tant sur votre résultat que sur la validité et la fiabilité de vos données. Ce rapport doit inclure un tableau de données complet similaire à celui que vous avez utilisé dans l’exercice préalable au laboratoire où vous avez trouvé la molarité de votre base. Ne faites pas de rapport sur le processus de normalisation de la base, si ce n’est pour rapporter la molarité du NaOH avec l’écart-type. Vous devez justifier l’abandon de l’un des essais de titrage du vinaigre. Vous devez montrer un calcul complet de la molarité et du % de masse du vinaigre. Votre réponse finale pour la molarité du vinaigre doit inclure un écart-type.
- Cette troisième section est celle où non seulement vous présentez vos données, mais où vous utilisez les valeurs obtenues comme preuves dans votre raisonnement. Des déclarations comme » voir le tableau des données pour les valeurs » ne sont pas acceptables !