Rédacteurs originaux – Bruce Tan dans le cadre du projet Pathophysiologie des problèmes complexes des patients de l’Université Bellarmine.
Principaux contributeurs – Bruce Tan, Morgan Yoder, Hannah McCabe, Elaine Lonnemann et Wendy Walker
Définition/Description
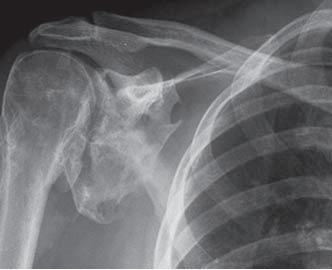
L’ossification hétérotopique (HO) désigne la formation d’os lamellaire à l’intérieur de structures de tissus mous où l’os ne devrait pas exister. Le développement de l’HO est extra-articulaire et se produit en dehors de la capsule articulaire. Le nouvel os ne touche généralement pas le périoste. L’HO peut également s’attacher à la corticale de l’os adjacent, avec une possible rupture de la corticale. Ce processus peut se produire dans des structures telles que la peau, le tissu sous-cutané, les muscles squelettiques et le tissu fibreux adjacent à l’os. Dans des formes plus rares, l’HO a été décrite dans les parois des vaisseaux sanguins et dans des sites intra-abdominaux tels que le mésentère. Le principal facteur de risque de l’HO est le traumatisme incitatif. En outre, il a été démontré que l’inflammation joue un rôle dans la formation de l’HO, car les cellules ostéoprogénitrices sont stimulées pour proliférer dans cet environnement. D’autres facteurs sont décrits plus en détail dans la section Étiologie. Bien que l’HO puisse être présente dans n’importe quel site, elle est plus fréquente dans les principales articulations telles que la hanche, le coude, l’épaule et le genou.
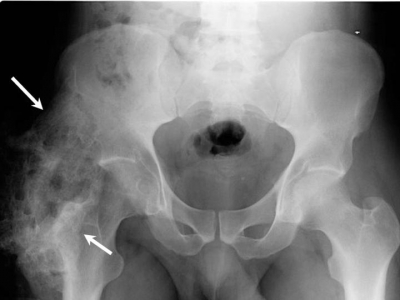
L’OH a été décrite pour la première fois par Patin en 1692 alors qu’il travaillait avec des enfants diagnostiqués avec une myositis ossificans progressiva. En 1918, Dejerine & Ceillier a détaillé les caractéristiques anatomiques, cliniques et histologiques de la formation osseuse ectopique chez des soldats ayant subi des blessures à la colonne vertébrale pendant la Première Guerre mondiale.Suivant les travaux de Dejerine & Ceillier, Marshall Urist a décrit les propriétés ostéoinductrices de la protéine morphogénique osseuse dans des zones ectopiques telles que le muscle. Cette découverte a été, et est toujours, considérée comme une « découverte marquante » dans la recherche orthopédique. Vous trouverez ci-dessous deux des articles de recherche originaux d’Urist :
- Os : formation par auto-induction
- Protéine morphogénique osseuse
Etiologie/Causes
La physiopathologie exacte de l’HO est inconnue. La transformation des cellules mésenchymateuses primitives du tissu conjonctif en tissu ostéoblastique et en ostéoïde implique des déclencheurs divers et mal compris. Ces déclencheurs incluent des lésions génétiques, post-traumatiques, neurogènes, post-chirurgicales et réactives des mains et des pieds.

Les formes génétiques comprennent deux types : Fibrodysplasie ossifiante progressive (FOP) et Hétéroplasie osseuse progressive(POH). Ces types sont décrits comme des dépôts massifs d’os hétérotopique autour de plusieurs articulations en l’absence d’un événement déclencheur (c’est-à-dire un traumatisme). Il s’agit du type d’HO le plus sévère, se formant progressivement tout au long de la vie et affectant gravement la santé, l’espérance de vie et la qualité de vie.
L’HO post-traumatique commence par une prolifération de cellules fusiformes dans la première semaine suivant l’événement traumatique. Dans les 1 à 2 semaines, l’ostéoïde primitif se développe. Après la deuxième semaine, on peut observer du cartilage primitif et de l’os tissé. L’os trabéculaire se forme 2 à 5 semaines après le traumatisme. Le phosphate de calcium amorphe est progressivement remplacé par des cristaux d’hydroxyapatite à mesure que la minéralisation progresse. Après environ 6 mois, on observe une apparition d’os véritable dans le tissu conjonctif entre les plans musculaires.
L’ossification hétérotopique neurogène se produit après une anémie falciforme, une hémophilie, un tétanos, une poliomyélite, une sclérose en plaques et une nécrolyse épidermique toxique. L’HO neurogène ne se développe que dans des sites distaux par rapport au niveau de la lésion de la moelle épinière. Les zones touchées par l’HO sont presque toujours du côté affecté de la lésion cérébrale ou de l’accident vasculaire cérébral.
L’HO post-chirurgicale se développe le plus souvent après des procédures qui nécessitent une réduction ouverte, une fixation interne et des chirurgies de remplacement de l’articulation, la THA étant la plus fréquente.
Les lésions réactives des mains et des pieds sont généralement associées au périoste ou au tissu fibreux périarticulaire, ce qui différencie cette catégorie de la myosite ossifiante. Ces lésions se présentent dans trois contextes clinico-radiologiques : ostéochondrome parostéal bizzare

tous, périosite réactive floride et exostoses sous-unguéales.
Prévalence
– Suite à une amputation des membres inférieurs : 7 %
– Après un traumatisme crânien : 11 % (fourchettes rapportées de 10 à 20 %)
La hanche est la plus fréquente, suivie du coude
– Après un traumatisme médullaire : 20 % (fourchettes rapportées de 20 à 40 %)
– Après une THA : 55 %
– Après une fracture et/ou une luxation du coude : 90 %
Après une fracture de l’avant-bras : 20 %
Dans une étude récente, Foruria et al. ont examiné la prévalence de l’ossification hétérotopique dans toutes les pathologies du coude entrant dans une salle d’urgence sur une période de 5 ans. Ils ont constaté que la prévalence la plus élevée d’HO se produisait dans les blessures de la terrible triade, les fractures-dislocations transolécraniennes et une fracture humérale distale associée. L’emplacement de l’ossification se trouvait le plus souvent sur la face postérieure du cubitus. Les facteurs de risque d’HO comprennent la luxation ou la subluxation au moment de la blessure, une blessure ouverte et une blessure thoracique grave. Lorsqu’une pathologie a été traitée chirurgicalement, 37% des participants ont développé une ossification.
Diagnostic clinique
Les signes et symptômes cliniques de l’HO peuvent apparaître dès 3 semaines ou jusqu’à 12 semaines après le traumatisme musculo-squelettique initial, la lésion de la moelle épinière ou d’autres événements précipitants. Le premier signe d’HO est généralement la perte de mobilité articulaire, puis la perte de fonction. D’autres signes peuvent suggérer la présence d’une HO : gonflement, érythème, chaleur, douleur locale, masse palpable et formation de contracture. Dans certains cas, une fièvre peut être présente.
Diagnostics différentiels : La phase inflammatoire initiale de l’HO peut imiter d’autres pathologies telles que la cellulite, la thrombophlébite, l’ostéomyélite ou un processus tumoral. Les autres diagnostics différentiels comprennent la TVP, l’arthrite septique, l’hématome ou la fracture. La TVP et l’HO ont été positivement associées. On pense que cela est dû à l’effet de masse et à l’inflammation locale de l’HO, favorisant la formation de thrombus. La formation du thrombus est causée par la compression veineuse et la phlébite.
Systèmes de classification
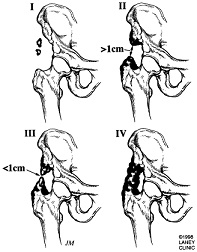
Classification de Brooker de l’ossification hétérotopique (suite à une THA)
Classe 1 : îlot osseux au sein d’un tissu mou autour de la hanche
Classe 2 : éperons osseux provenant du bassin de l’extrémité proximale du fémur laissant au moins 1 cm entre les surfaces osseuses opposées
Classe 3 : Éperons osseux provenant du bassin ou du fémur proximal laissant <1 cm entre les surfaces osseuses opposées
Classe 4 : Ankyloses de la hanche
Brooker n’a pas décrit de classe 0 mais des études ultérieures utilisant la classification de Brooker ont défini la classe 0 comme l’absence d’HO radiographique.
Catégorisation de Schmidt et Hackenbrock de l’ossification hétérotopique (après THA)
Région 1 : Ossification hétérotopique strictement sous la pointe du grand trochanter
Région 2 : Ossification hétérotopique sous et au-dessus de la pointe du grand trochanter
Région 3 : Ossification hétérotopique strictement au-dessus de la pointe du grand trochanter
Grade A : Ossification hétérotopique unique ou multiple <10 mm d’extension maximale sans contact avec le bassin ou le fémur
Grade B : Ossification hétérotopique >10 mm sans contact avec le bassin mais avec un contact possible avec le fémur ; pas de pontage du fémur à la partie proximale du grand trochanter ; pas de preuve d’ankyloses
Grade C : Ankylose par pontage ferme du fémur au bassin
Catégorisation de l’Ossification Hétérotopique de McAfee (après arthroplastie totale du disque)
0 : Pas d’HO
1 : Îlots d’os non situés dans les marges du disque et n’interférant pas avec le mouvement
2 : Os dans les marges du disque mais ne bloquant pas le mouvement
3 : Os dans les marges du disque et interférant avec le mouvement de la prothèse
4 : Ankylose osseuse
Stades de développement
Chronologie du développement de l’ossification hétérotopique
- 0 jours : +/- érythème, gonflement, sensibilité
- 7 jours : masse cliniquement palpable
- 7-14 jours : ombre mal définie sur la radiographie
- 14-21 jours : dépôt ostéoïde, ombres radiographiques
- 21-35 jours : radiodensités cotonneuses ; l’effet » voile en pointillé »
- 24 jours : preuve radiographique définitive
- 30 jours : la minéralisation présente un motif zonal (mieux vu sur le scanner)
- 45 jours : motif histologique » zonal » évident, reflétant une minéralisation bien formée à la périphérie
- 180-365 jours : développement d’un os mature
Tests diagnostiques et tests de laboratoire
Ultrasonographie

– Détection de l’HO 2 semaines plus tôt que par radiographie.Ray
– Plus précise que n’importe quel test de laboratoire
– Aide les cliniciens à préconiser une physiothérapie rapide/agressive
– Élimine le taux élevé de faux positifs de l’examen physique seul
Scintigraphie osseuse à trois phases
– Fins de suivi diagnostique et thérapeutique
– Les phases 1 et 2 sont indicatives d’une hyperémie et d’une accumulation de sang (précurseurs du processus d’HO)
– Généralement positive après 2 à 4 semaines
– Des séries de scintigraphies osseuses montrant l’HO sont effectuées à plusieurs reprises.4 semaines
– Des scintigraphies osseuses sérielles sont utilisées pour surveiller l’activité métabolique de l’HO afin de déterminer le moment optimal de la résection chirurgicale et de prédire l’occurrence postopératoire
Radiographie
– La masse des tissus mous est la découverte radiographique la plus précoce
– L’HO observée sur les radiographies 4-6 semaines après la blessure a un aspect typique d’ossification circonférentielle avec un centre lucide
– Impossible de détecter la minéralisation de l’HO pendant les premières semaines après le traumatisme/la survenue
– Fréquemment utilisé pour classer l’HO après une THA
– Diagnostic différentiel : fragments de fracture par avulsion, corps ostéochondraux, calcification des tissus mous non osseux et ostéosarcome
Image par résonance magnétique et tomodensitométrie
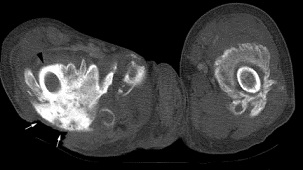
– L’IRM n’est pas utilisée de manière systématique pour l’évaluation de l’HO
– La TDM peut détecter l’ossification des tissus mous à des stades plus précoces que la radiographie standard
Théchnétium à troisphase du technétium-99m (99mTc) méthylène diphosphonate
– Modalité d’imagerie la plus sensible pour la détection précoce et l’évaluation de la maturité de l’HO
– Peut être utilisée pour surveiller l’activité métabolique de l’HO et déterminer le moment approprié pour la chirurgie et prédire la récidive postopératoire
– Généralement positive >2 semaines avant la preuve radiographique de l’HO
Prostaglandine E2 : (PGE2)
– Surveiller l’excrétion de PGE2 dans les urines de 24 heures
– La PGE2 est ressentie comme un marqueur osseux fiable pour la détection précoce et la détermination de l’efficacité du traitement
– Une augmentation soudaine est une indication pour la scintigraphie osseuse
Phosphatase alcaline : (ALP)
– Fréquemment utilisée dans la détection précoce de l’HO
– Les valeurs d’ALP sont augmentées dans l’HO précoce et atteignent un plateau à ~4 semaines
– Ne peut pas être utilisée pour tirer des conclusions cliniques sur la maturité ou la récurrence de l’HO
– Les fractures aiguës ont souvent des valeurs d’ALP similaires, limitant l’utilité des valeurs ALP dans le diagnostic de l’HO
L’élévation des taux de créatine kinase
– Corrélée avec l’implication histologique du muscle et la sévérité de la maladie
– Non spécifique à l’HO
– Peut prédire un risque plus élevé de développement et de sévérité de l’HO
– Peut être utile dans la planification et l’évaluation de la réponse au traitement
Matrice métalloprotéinase-.9
– Les modèles animaux marins suggèrent que cela pourrait être un biomarqueur précoce de la formation de l’HO
Note clinique : l’absence de mesures objectives simples dans la détection de la formation d’os hétérotopique fait que l’HO est mal diagnostiquée dans les premiers stades, ce qui entraîne un retard de traitement.
Implication systémique
Les preuves montrent qu’il n’y a pas d’effets systémiques secondaires à la formation d’ossification hétérotopique. Les sites les plus courants où cette affection se présente sont les hanches, les genoux, la colonne vertébrale, le coude, les poignets, les mains et tout site qui est impliqué dans un événement traumatique.
Co-morbidités associées
Les conditions les plus courantes trouvées en conjonction avec l’ossification hétérotopique :
- Spondylarthrite ankylosante
- Polyarthrite rhumatoïde
- Ostéoarthrite hyperpertrophique
- Hystérostose squelettique idiopathique diffuse
- Maladie de Paget
- Quadriplégie et . paraplégie
Gestion médicale (meilleures preuves actuelles)
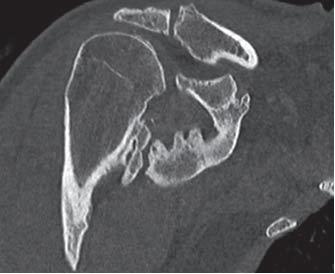
Le traitement de l’ossification hétérotopique dépend largement de la quantité de formation osseuse ectopique, de la localisation et des limitations fonctionnelles associées du patient.
Le premier objectif de la prise en charge médicale est d’identifier les patients à risque de développer une HO et de les traiter de manière prophylactique. La recherche soutient deux autres approches pour la gestion médicale de l’HO : 1)l’excision chirurgicale et 2) la radiothérapie.
Traitement prophylactique :
Des recherches supplémentaires doivent être menées dans ce domaine, cependant il existe actuellement des options expérimentales. Celles-ci comprennent :
La radiothérapie locale
- Diminution de l’incidence de toutes les classes d’HO de Brooker après une THA, mais a plus d’effet sur la prévention des classes 3 et 4 de Brooker par rapport aux AINS
- Post-opératoire meilleur que pré-opératoire
- L’utilisation de la radiothérapie comme traitement prophylactique provient principalement de la littérature concernant l’arthroplastie totale de la hanche.
- La radiothérapie des cellules mésenchymateuses pluripotentielles peut prévenir efficacement le développement de l’HO.
- Une dose de 700-800 cGy de radiation locale dans les quatre premiers jours post-opératoires a montré qu’elle prévenait la formation d’HO chez les patients à haut risque.
L’indomenthacine par voie orale
Médicaments :
Des médicaments sont prescrits aux patients qui présentent un risque de développer une ossification hétérotopique, à titre préventif et pour faciliter le traitement après la formation de lésions hétérotopiques. Les deux types de médicaments dont il a été démontré qu’ils présentent à la fois des avantages en termes de prophylaxie et de traitement sont les suivants :
Les anti-inflammatoires non stéroïdiens : AINS
Indométhacine (double action)
1. Inhibition de la différenciation des cellules mésenchymateuses en cellules ostéogéniques (directe)
2. Inhibition du remodelage osseux post-traumatique par suppression de la réponse médiée par les prostaglandines (indirecte) et propriétés anti-inflammatoires
Les biphosphonates:
Trois actions
1. Inhibition de la précipitation du phosphate de calcium
2. Ralentissement de l’agrégation des cristaux d’hydroxyapatite
3. Inhibition de la transformation du phosphate de calcium en hydroxyapatite
Note clinique : Les cliniciens doivent être conscients des complications potentielles (principalement liées à l’appareil digestif) chez les patients qui prennent des AINS de façon systématique.
Intervention chirurgicale:
Les deux principaux objectifs de l’intervention chirurgicale sont de modifier la position de l’articulation affectée ou d’améliorer son amplitude de mouvement (ROM). Grâce à ses travaux, Garland a créé un calendrier recommandé pour l’intervention chirurgicale :
- 6 mois après le développement traumatique de l’HO
- 1 an après le développement de l’HO secondaire à une lésion de la moelle épinière
- 18 mois après le développement de l’HO secondaire à un traumatisme crânien
Les calendriers ci-dessus ont été établis pour déterminer le moment le plus optimal pour l’intervention chirurgicale. Les cliniciens doivent déterminer si la lésion a atteint sa maturation avant l’excision chirurgicale afin de diminuer le risque de complications peropératoires telles que l’hémorragie, et la réapparition de la lésion ectopique. L’utilisation de scintigraphies osseuses pour déterminer l’activité métabolique de la lésion et les taux sériques d’ALP sont des aides courantes dans ce processus de décision.

Shehab et al. décrivent les critères pour recommander l’ablation chirurgicale de l’ossification hétérotopique. Ces critères sont les suivants :
- La ROM de l’articulation concernée est significativement limitée (par exemple, la hanche doit avoir < 50 deg ROM) pour la plupart des patients, la progression vers une ankylose articulaire est la complication la plus grave de l’ossification hétérotopique.
- Absence de fièvre locale, de gonflement, d’érythème ou d’autres signes cliniques d’ossification hétérotopique aiguë.
- Taux de phosphate alcalin sérique normal.
- Retour des résultats de la scintigraphie osseuse à la normale ou proche de la normale ; si des scintigraphies osseuses quantitatives en série sont obtenues, il doit y avoir une tendance fortement décroissante suivie d’un état stable pendant 2 à 3 mois.
Réhabilitation postopératoire
Il est recommandé de commencer un programme de réhabilitation dans les premières 24 heures après la chirurgie. Le programme doit durer 3 semaines pour prévenir les adhérences.
Gestion de la thérapie physique
La thérapie physique s’est avérée bénéfique pour les patients souffrant d’ossification hétérotopique. La PT préopératoire peut être utilisée pour aider à présélectionner les structures autour de la lésion. Les exercices de ROM (PROM, AAROM, AROM) et le renforcement aideront à prévenir l’atrophie musculaire et à préserver le mouvement articulaire.
Note clinique : il faut être prudent lorsqu’on travaille avec des patients présentant des lésions hétérotopiques connues. Une thérapie trop agressive peut aggraver l’état et entraîner une inflammation, un érythème, une hémorragie et une douleur accrue.
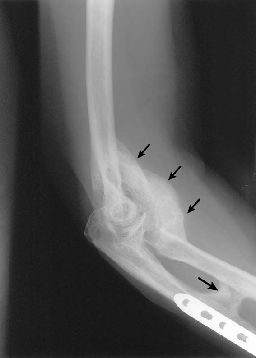
La rééducation postopératoire s’est également avérée bénéfique pour les patients ayant subi une résection chirurgicale récente de l’ossification hétérotopique. La gestion post-opératoire de l’HO est similaire au traitement pré-opératoire, mais l’accent est mis beaucoup plus sur le contrôle de l’œdème, la gestion de la cicatrice et la prévention des infections. Calandruccio et al. ont décrit un protocole de rééducation pour les patients ayant subi une excision chirurgicale de l’ossification hétérotopique du coude. Les phases de la rééducation et les objectifs de chaque phase sont les suivants :
Phase I (semaine 1)
Objectifs :
- Prévenir l’infection
- Protéger et diminuer le stress sur le site chirurgical
- Diminuer la douleur
- Contrôler et diminuer l’œdème
- Maintenir l’amplitude de mouvement à 80% de l’articulation touchée
- Maintenir l’amplitude de mouvement de l’articulation proximale et distale par rapport au site chirurgical
Phase II (2-…8 semaines)
Objectifs :
- Réduire la douleur
- Gérer l’œdème
- Encourager les performances limitées des AVQ
- Promouvoir la mobilité de la cicatrice et le remodelage approprié
- Promouvoir la pleine. ROM de l’articulation affectée
- Encourager les contractions musculaires de qualité
 Photo courtoisie de prosportscare.com
Photo courtoisie de prosportscare.com
Phase III (9-24 semaines)
Objectifs :
- Auto-gérer la douleur
- Prévenir les flambées-up avec des activités fonctionnelles
- Améliorer la force
- Améliorer la ROM (si elle est encore limitée)
- Retourner aux niveaux d’activité précédents
Casavant et Hastings fournissent également un grand aperçu de l’évaluation et de la gestion de l’ossification hétérotopique dans leur article intitulé Heterotopic Ossification about the Elbow : A Therapist’s Guide to Evaluation and Management.
Note clinique : Les deux études utilisées ci-dessus étaient principalement axées sur la réadaptation du coude secondaire à une ossification hétérotopique. Cependant, les objectifs et les étapes du processus de réadaptation peuvent être utilisés comme guide lors du traitement d’autres sites.
Rapport de cas
Titre : Ossification hétérotopique causant une radiculopathie après une arthroplastie totale de disque lombaire
Mots clés : Ossification hétérotopique, kinésithérapie, arthroplastie totale de disque, radiculopathie
Compte de mots : 520
Auteurs : Keith L. Jackson, Justin M. Hire, Jeremy M. Jacobs, Charles C. Key et John G. DeVine (modifié par Morgan Blake et Hannah McCabe)
Abstract :
Ce cas détaille les complications rencontrées par un homme en raison du développement d’une ossification hétérotopique postopératoire dans sa colonne lombaire.
Introduction :
L’arthroplastie discale totale est une stratégie de traitement relativement nouvelle pour les lombalgies discogènes lombaires qui a montré des résultats prometteurs à court et moyen terme. Les complications spécifiques qui peuvent accompagner l’arthroplastie totale du disque comprennent la fracture du corps vertébral, l’ossification hétérotopique (HO), la malposition de l’implant et l’extrusion précoce ou tardive du composant. Ce cas détaille un placement postérieur du composant qui a contribué à une croissance osseuse hétérotopique dans le canal rachidien, provoquant un empiètement neural et une radiculopathie et nécessitant finalement une extraction du composant, une décompression et une arthrodèse lombaire.
Présentation du cas :
- Subjectif : un homme de 45 ans se présente à la clinique avec une douleur à la jambe R d’apparition récente. Il nie les paresthésies ou la perte de la fonction motrice, et il nie également toute histoire antérieure de formation d’HO, de traumatisme ou d’arthrite inflammatoire. Son MPH comprend une arthroplastie totale du disque lombaire L5/S1 il y a deux ans pour une douleur dorsale discogène. Il rapporte qu’après la chirurgie, il a eu une réduction significative de ses symptômes mais a développé cette nouvelle douleur il y a environ 6 mois.
- Informations démographiques : 45 ans, Homme, travaille pour UPS en tant que facteur
- Diagnostic médical : suspicion d’HO
- Co-morbidités : HTN, DM
- Soins/traitements antérieurs : physiothérapie (des améliorations minimes ont été notées)
- Résultats de l’auto-évaluation : Oswestry : 46% (invalidité sévère)
- Objectif : L’examen physique a révélé une ROM lombaire limitée en flexion avant en raison d’une douleur à la jambe R, un test positif d’élévation d’une jambe, une force de 5/5 pour tous les principaux groupes musculaires, une sensation intacte et des réflexes normaux (2+).
Le patient a été adressé à son prestataire de soins primaires qui a effectué des tests supplémentaires. Les résultats des tests supplémentaires étaient :
- Les radiographies ont démontré un empiètement de l’implant dans le canal rachidien avec une formation osseuse hétérotopique en dehors des marges du disque.
- Le myélogramme par tomographie assistée par ordinateur a révélé une compression de la racine nerveuse traversante secondaire à la plaque terminale inférieure de l’implant qui résidait en arrière de la marge de la plaque terminale vertébrale ainsi qu’une croissance osseuse postérieure associée plus loin dans le canal.
Impression clinique :
Le patient présente une ROM lombaire réduite, avec des antécédents de traumatisme de la colonne lombaire dus à l’arthroplastie discale lombaire. Ces facteurs et l’imagerie positive ont permis de diagnostiquer une HO chez le patient.
Intervention :
Le patient a choisi de subir une ablation chirurgicale de son arthroplastie lombaire avec fusion de L5/S1 et décompression de l’HO. Le patient est retourné en physiothérapie en postopératoire pour sa récupération.
Résultats :
6 semaines après l’opération, le patient rapporte un soulagement complet de sa douleur radiculaire aux jambes. Les radiographies démontrent une fusion solide sans récidive de formation d’HO.
Discussion :
En tant que kinésithérapeute, il est important de considérer l’HO dans votre diagnostic différentiel lorsque vous traitez des patients ayant des antécédents de traumatisme ou de chirurgie. Il est particulièrement important de se souvenir des signes et symptômes de l’HO lorsqu’on traite des patients dont la ROM est limitée. Nous pouvons être le premier professionnel de santé à reconnaître le développement de l’HO.
Remerciements :
Cas adapté de « Heterotopic Ossification Causing Radiculopathy after Lumbar Total Disc Arthroplasty »
Etudes de cas
Syndesmose et ossification tibiofibulaires. Rapport de cas : Séquelles d’entorses de la cheville chez un adolescent footballeur.
- Kennedy MA, Sama AE, Sigman M. Tibiofibular syndesmosis and ossification. case report : sequelae of ankle sprain in an adolescent football player. Journ of Emer Med 2000 ; 18 : 233-240.
L’ossification mésentérique hétérotopique (« intraabdominal myositis ossificans ») : A Case Report.
- Bovo G, Romano F, Perego E, Franciosi C et al. Heterotopic mesenteric ossification (« intraabdominal myositis ossificans ») : a case report. International Journal of Surgical Pathology 2004 ; 12 : 407-409.
Un cas d’ossification du psoas suite à l’utilisation de BMP-2 pour une fusion postérolatérale à L4-L5.
- Brower RS, Vickroy NM. A case of psoas ossification from the use of BMP-2
for posterolateral fusion at L4-L5.Spine 2008 ; 18 : 653-655.<span />
Ossification hétérotopique infrapatellaire après reconstruction du ligament croisé antérieur.
- Valencia H, Gavín C. Infrapatellar heterotopic ossification after anterior cruciate ligament reconstruction. Chirurgie du genou, traumatologie du sport, arthroscopie : Official Journal Of The ESSKA ; 15(1) : 39-42. Disponible sur : MEDLINE.]
L’ossification hétérotopique du ligament collatéral ulnaire : Description d’un cas chez un athlète haltérophile de haut niveau.
- A Giombini, L Innocenzi, G Massazza, F Fagnani, et al. Ossification hétérotopique du ligament collatéral ulnaire : description d’un cas chez un athlète haltérophile de haut niveau. Journal of Sports Medicine and Physical Fitness. 2005 Sep 1;45(3) : 370-80. Dans : ProQuest Medical Library . Disponible auprès de : ProQuest ; Document ID : 942792311]
Ressources
Le mystère de l’ossification hétérotopique et comment il a affecté ma vie
- 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 Mavrogenis AF, Soucacos PN, Papagelopoulos PJ. Heterotopic Ossification Revisited. Orthopédie. 2011Jan;34(3):177.
- 2.0 2.1 2.2 2.3 2.4 2.5 McCarthy EF, Sundaram M. Heterotopic ossification : a review. Skeletal Radiol 2005 ; 34 : 609-619.
- 3.0 3.1 3.2 3.3 3.4 3.5 3.6 Firoozabadi R, Alton T, Sagi HC. Heterotopic Ossification in Acetabular Fracture Surgery. Journal de l’Académie américaine des chirurgiens orthopédiques. 2017;25(2):117-24.
- 4.0 4.1 4.2 4.3 4.4 4.5 Bossche LV, Vanderstraeten G. Heterotopic ossification : a review. J Rehabil Med 2005 ; 37 : 129-136.5. Pape HC et al. Current concepts in the development of hetetrotopic ossification. Journ Bone and Joint Surg 2004 ; 86 : 783-787.
- 5.0 5.1 5.2 5.3 Pape HC et al. Current concepts in the development of hetetrotopic ossification. Journ Bone and Joint Surg 2004 ; 86 : 783-787.
- 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Hsu JE, Keenan MA. Revue actuelle de l’ossification hétérotopique. UPOJ 2010 ; 20 : 126-130.
- 7.0 7.1 7.2 7.3 7.4 Foruria AM, Augustin S, Morrey BF, Sanchez-Sotelo Joaquin. Ossification hétérotopique après une intervention chirurgicale pour des fractures et des fractures-dislocations impliquant l’aspect proximal du radius ou du cubitus. The Journal of Bone and Joint Surgery, Incorporated. 2015May15;95-A(10):e66(1)-e66(7).
- 8,0 8,1 Dalury DF, Jiranek WA. L’incidence de l’ossification hétérotopique après une arthroplastie totale du genou. Journal of Arthroplasty 2004 ; 19 : 447-457.
- 9.0 9.1 9.2 Shehab D, Elgazzar AH, Collier BD. Heterotopic ossification. Jour de la médecine nucléaire 2002 ; 43 : 346-353.
- Hug KT, Alton TB, Gee AO. In Brief : Classifications en bref : Classification Brooker de l’ossification hétérotopique après une arthroplastie totale de la hanche. Orthopédie clinique et recherches connexes®. 2014;473(6):2154-7.