Solubilité
Pourquoi certains solides se dissolvent-ils dans l’eau ?
Le sucre que nous utilisons pour sucrer le café ou le thé est un solide moléculaire, dans lequel les molécules individuelles sont maintenues ensemble par des forces intermoléculaires relativement faibles. Lorsque le sucre se dissout dans l’eau, les liaisons faibles entre les molécules individuelles de saccharose sont rompues, et ces molécules de C12H22O11 sont libérées en solution.
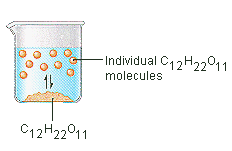
Il faut de l’énergie pour rompre les liaisons entre les molécules de C12H22O11 dans le saccharose. Il faut également de l’énergie pour briser les liaisons hydrogène de l’eau qui doivent être rompues pour insérer une de ces molécules de saccharose dans la solution. Le sucre se dissout dans l’eau parce que de l’énergie est dégagée lorsque les molécules de saccharose légèrement polaires forment des liaisons moléculaires avec les molécules d’eau polaires. Les liaisons faibles qui se forment entre le soluté et le solvant compensent l’énergie nécessaire pour perturber la structure du soluté pur et du solvant. Dans le cas du sucre et de l’eau, ce processus fonctionne si bien que jusqu’à 1800 grammes de saccharose peuvent se dissoudre dans un litre d’eau.
Les solides ioniques (ou sels) contiennent des ions positifs et négatifs, qui sont maintenus ensemble par la forte force d’attraction entre les particules de charges opposées. Lorsqu’un de ces solides se dissout dans l’eau, les ions qui forment le solide sont libérés dans laosolution, où ils s’associent aux molécules polaires du solvant.

| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Nous pouvons généralement supposer que les sels se dissocient en leurs ions lorsqu’ils se dissolvent dans l’eau. Les composés ioniques se dissolvent dans l’eau si l’énergie dégagée lorsque les ions interagissent avec les molécules d’eau compense l’énergie nécessaire pour rompre les liaisons ioniques dans le solide et l’énergie nécessaire pour séparer les molécules d’eau afin que les ions puissent être insérés dans la solution.
![]()
Equilibres de solubilité
Les discussions sur les équilibres de solubilité reposent sur l’hypothèse suivante : Lorsque les solides se dissolvent dans l’eau, ils se dissocient pour donner les particules élémentaires à partir desquelles ils sont formés. Ainsi , les solides moléculaires se dissocient pour donner des molécules individuelles
| H2O | ||
| C12H22O11(s) | C12H22O11(aq) |
et les solides ioniques se dissocient pour donner des solutions des ions positifs et négatifs qu’ils contiennent.
| H2O | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |
Lorsque le sel est ajouté pour la première fois, il se dissout et se dissocie rapidement. La conductivité de la solution augmente donc rapidement dans un premier temps.
| dissoudre | ||||
| NaCl(s) | Na+(aq) | + | Cl-(aq) |

Les concentrations de ces ions deviennent bientôt suffisamment importantes pour que la réaction inverse commence à entrer en compétition avec la réaction directe, ce qui entraîne une diminution de la vitesse à laquelle les ions Na+ et Cl- entrent dans la solution.
| associés | Na+(aq) | + | Cl-.(aq) | NaCl(s) | |||||
| précipité |
Eventuellement, les concentrations en ions Na+ et Cl- deviennent suffisamment importantes pour que la vitesse à laquelle se produisent les précipitations équilibre exactement la vitesse à laquelle le NaCldissout. Une fois que cela se produit, il n’y a pas de changement dans la concentration de ces ions avec le temps et la réaction est à l’équilibre. Lorsque ce système atteint l’équilibre, on l’appelle une solution saturée, car elle contient la concentration maximale d’ions qui peuvent exister en équilibre avec le sel solide. La quantité de sel qui doit être ajoutée à un volume donné de solvant pour former une solution saturée est appelée la solubilité du sel.
![]()
Règles de solubilité
Il existe un certain nombre de modèles dans les données obtenues en mesurant la solubilité de différents sels. Ces modèles constituent la base des règles décrites dans le tableau ci-dessous,qui peuvent guider les prédictions sur la dissolution d’un sel donné dans l’eau. Ces règles sont basées sur les définitions suivantes des termes soluble, insoluble et légèrement soluble.
- Un sel est soluble s’il se dissout dans l’eau pour donner une solution dont la concentration est d’au moins 0,1 moles par litre à température ambiante.
- Un sel est insoluble si la concentration d’une solution aqueuse est inférieure à 0,001 M à température ambiante.
- Les sels peu solubles donnent des solutions qui se situent entre ces extrêmes.
Règles de solubilité des composés ioniques dans l’eau
Sels solubles
1. Les ions Na+, K+ et NH4+ forment des sels solubles. Ainsi, NaCl, KNO3, (NH4)2SO4, Na2S et (NH4)2CO3 sont solubles.
2. L’ion nitrate (NO3-) forme des sels solubles. Ainsi, Cu(NO3)2 et Fe(NO3)3 sont solubles.
3. Les ions chlorure (Cl-), bromure (Br-) et iodure (I-) forment généralement des sels solubles. Les exceptions à cette règle sont les sels des ions Pb2+, Hg22+, Ag+ et Cu+. ZnCl2 est soluble, mais CuBr ne l’est pas.
4. L’ion sulfate (SO42-) forme généralement des sels solubles. Les exceptions sont BaSO4, SrSO4 et PbSO4, qui sont insolubles, et Ag2SO4, CaSO4 et Hg2SO4, qui sont légèrement solubles.
Sels insolubles
1. Les sulfures (S2-) sont généralement insolubles. Les exceptions comprennent Na2S, K2S, (NH4)2S, MgS, CaS, SrS et BaS.
2. Les oxydes (O2-) sont généralement insolubles. Les exceptions comprennent Na2O, K2O, SrO et BaO, qui sont solubles, et CaO, qui est légèrement soluble.
3. Les hydroxydes (OH-) sont généralement insolubles. Les exceptions comprennent NaOH, KOH, Sr(OH)2 et Ba(OH)2, qui sont solubles, et Ca(OH)2, qui est légèrement soluble.
4. Les chromates (CrO42-) sont généralement insolubles. Les exceptions sont Na2CrO4, K2CrO4, (NH4)2CrO4 et MgCrO4.
5. Les phosphates (PO43-) et les carbonates (CO32-) sont généralement insolubles. Les exceptions comprennent les sels des ions Na+, K+ et NH4+.
![]()
.