Découvert pour la première fois en 1961 et jusque dans les années 70, l’amiodarone a été utilisé pour ses propriétés antiarythmiques, mais pas officiellement avant l’année 1985, lorsque les États-Unis ont finalement approuvé son utilisation. La Food and Drug Administration (FDA) avait été réticente à approuver le médicament en raison de rapports initiaux montrant une incidence accrue d’effets pulmonaires indésirables. Les sociétés pharmaceutiques européennes ont commencé à discuter avec l’institution au milieu des années 80 et ont menacé de suspendre leur fourniture (gratuite) du médicament aux médecins américains, si la FDA n’accordait pas d’autorisation officielle. L’autorisation est finalement délivrée en décembre 1985, ce qui en fait l’un des rares médicaments approuvés par la FDA sans essais cliniques randomisés préalables.
I – Mécanisme d’action et effets pharmacologiques
Les deux atomes d’iode contenus dans la molécule d’amiodarone, un dérivé du benzofurane, sont essentiels à ses propriétés antiarythmiques. En utilisant la classification de Vaughan-Williams des médicaments antiarythmiques, l’amiodarone prolonge le potentiel d’action de phase 3 des cellules cardiaques et elle possède également toutes les caractéristiques électrophysiologiques de classe 4 également.
L’absorption est extrêmement lente et la biodisponibilité est également faible et variable. La latence entre l’administration et l’effet peut cependant être réduite en utilisant une charge élevée de la dose orale ou intraveineuse.
D’autre part, le médicament se lie complètement aux protéines plasmatiques et a un grand volume de distribution. Il est ensuite métabolisé dans le foie. La clairance est également faible avec une demi-vie d’élimination estimée à 30-180 jours due à son métabolite, la déséthylamiodarone, qui entraîne l’accumulation du médicament dans les tissus périphériques qui servent de réservoirs en raison de leur affinité pour les phospholipides intralisosomaux. Ces corps d’inclusion ont été trouvés dans les poumons, le foie, le cœur, la peau, l’épithélium cornéen et les nerfs périphériques, ce qui explique ses effets toxiques dans de nombreux organes et la relation proportionnelle entre la toxicité, la durée d’utilisation et la dose cumulative.
Une dose d’entretien quotidienne normale de 200 mg d’amiodarone libère 75 mg d’iode organique. Il est important de souligner que les besoins quotidiens normaux en iode sont de 0,2 à 0,8 mg – plus de 100 fois inférieurs à ce qui est délivré par l’amiodarone.
L’amiodarone à faible dose (100 à 300 mg par jour) est efficace pour une grande variété d’arythmies ventriculaires et supraventriculaires, y compris dans le cadre d’une stratégie de contrôle du rythme chez les patients atteints de fibrillation auriculaire, en particulier en présence d’une cardiopathie structurelle. Lorsque d’autres médicaments n’ont pas réussi à contrôler les arythmies, des doses élevées d’amiodarone seront nécessaires et produiront une augmentation de l’incidence des effets secondaires indésirables graves.
II – Impact du traitement par amiodarone sur la survie dans le contexte clinique
Plusieurs effets secondaires ont été décrits au fil du temps, en particulier en cas d’utilisation chronique. On estime que la prévalence des effets indésirables liés au traitement par amiodarone est de 15% la première année et de 50% en cas d’administration prolongée. En outre, 20 % des patients doivent interrompre le traitement en raison d’effets tels que des lésions hépatiques, des troubles de la fonction thyroïdienne et un squelette pulmonaire chronique, qui ont été décrits dans une proportion allant jusqu’à 1 % par année de traitement, avec des dommages cumulatifs compris entre 5 et 10 %. L’atteinte pulmonaire est la plus connue : elle est produite après une longue exposition à l’amiodarone (2,3), mais des cas de toxicité aiguë ont également été rapportés.
Voici les effets collatéraux les plus fréquents du médicament :
a) Poumon
La toxicité pulmonaire induite par l’amiodarone (TPA) est l’un des effets secondaires les plus graves de l’utilisation. Son incidence est d’environ 5 % lorsque des doses de 400 mg ou plus sont utilisées quotidiennement.
Il est intéressant de noter que l’étude AFFIRM (atrial fibrillation follow-up investigation of rhythm management study) a trouvé une incidence accrue de toxicité pulmonaire chez les patients ayant une maladie pulmonaire préexistante. Cependant, la mortalité due à des causes pulmonaires et la mortalité globale n’étaient pas plus élevées chez ces patients, par rapport à ceux sans maladie pulmonaire préexistante.
Le mécanisme d’action de cette pathologie peut être direct par la libération de radicaux libres, ou indirect par l’hypersensibilité du patient. Les facteurs de risque associés à cet effet indésirable n’ont pas été bien identifiés, mais peuvent être liés à des doses cumulées, à des doses quotidiennes supérieures à 400 mg, à un âge avancé et à une maladie pulmonaire sous-jacente.
La toxicité pulmonaire de l’amiodarone peut se présenter de différentes manières : pneumonie maladie interstitielle, détresse respiratoire ou masses pulmonaires solitaires. Les scénarios cliniques sont variables, les symptômes les plus courants étant la dyspnée et la toux sèche, mais les symptômes peuvent également inclure la fièvre, la perte de poids, l’hémoptysie et la douleur thoracique aggravée par les mouvements respiratoires. Les radiographies du thorax montrent des modifications bilatérales irrégulières ou inégales de l’infiltration interstitielle (figures 1 et 2). Les épreuves fonctionnelles respiratoires montrent un schéma restrictif avec une capacité pulmonaire totale réduite et diffuse. Le mécanisme de la toxicité pulmonaire n’a pas été établi, mais semble également être lié à la dose.
Le diagnostic de la TAP est compliqué par ses symptômes non spécifiques, ses résultats cliniques et les résultats de l’imagerie et des tests de laboratoire, il est donc considéré comme un diagnostic d’exclusion. Le diagnostic différentiel doit être effectué avec une insuffisance cardiaque, une pneumonie, une embolie pulmonaire et une maladie néoplasique. Le pronostic est favorable, avec un faible taux de mortalité, sauf pour les patients qui développent une détresse respiratoire, dont la mortalité approche les 50%. (3)
Le traitement repose sur l’arrêt du médicament et l’administration de corticostéroïdes, qui doivent être poursuivis pendant plusieurs mois malgré les cas d’amélioration initiale de l’état du patient, car la longue demi-vie de l’amiodarone peut entraîner une nouvelle exacerbation des symptômes. La prévention et la détection précoce de cette complication potentielle nécessitent une radiographie pulmonaire obtenue au début du traitement et tous les ans par la suite.
b) Thyroïde
Des signes cliniques d’hypothyroïdie apparaissent chez jusqu’à 20% des patients prenant de l’amiodarone. L’amiodarone empêche la conversion périphérique de la T4 en T3 et modifie les tests de la fonction thyroïdienne. Les grandes quantités d’iode contenues dans l’amiodarone peuvent expliquer ces effets.
L’hypothyroïdie est facilement prise en charge par la lévothyroxine et n’est généralement pas une cause d’arrêt de l’amiodarone. L’hyperthyroïdie survient chez 3 % des patients dans les régions déficitaires en iode, mais chez 20 % des patients dans les régions où l’iode est suffisant. Elle peut être difficile à reconnaître car de nombreux signes typiques à médiation adrénergique sont bloqués par l’amiodarone.
Chez les patients prenant de l’amiodarone, le premier mois de traitement a révélé une augmentation de la T4 (20%-40%), de la T3 inverse (20%) et de la TSH, et une diminution de la T3, qui tend à revenir à la normale à trois mois.
Dans certains cas, la récurrence de la fibrillation auriculaire chez des patients sous traitement d’entretien à l’amiodarone, a nécessité une évaluation rapide pour exclure une hyperthyroïdie induite par l’amiodarone.
Le risque accru survient chez les patients présentant une fonction thyroïdienne de base anormale (maladie auto-immune, goitre) et chez les personnes âgées. Les femmes ayant des anticorps antithyroïdiens positifs sont sept fois plus exposées à cette complication.
Nous recommandons une analyse de la TSH, de la T4 et de la T3 au début du traitement, un mois après le début du traitement et ensuite tous les six mois.
Le diagnostic est présumé lorsqu’il y a une augmentation des taux de TSH et une diminution de la T4 et de la T3. Nous souhaitons rappeler à nos lecteurs que l’augmentation de la TSH pendant les trois premiers mois après le début du traitement par l’amiodarone n’est pas un problème en soi car il peut s’agir d’un phénomène transitoire – le traitement par l’amiodarone peut être poursuivi à condition d’ajouter de la lévothyroxine. La triiodothyronine peut également être ajoutée à certains moments si les valeurs de TSH n’ont pas diminué de manière adéquate. La prise en charge nécessitera alors l’aide d’un endocrinologue expérimenté et l’arrêt du traitement par amiodarone.
Chez tous les patients, les taux de thyrotropine doivent être vérifiés avant d’initier le traitement par amiodarone et tous les mois par la suite.
c) Autres domaines – gastro-intestinal, hépatique, cardiaque, ophtalmique, cutané
Les troubles gastro-intestinaux tels que nausées, vomissements, diarrhée ou anorexie sont fréquents (30 %) au départ. Cependant, certains des effets secondaires gastro-intestinaux les plus redoutés – hépatite et cirrhose du foie – sont rares (<3%). Il est recommandé de tester la fonction hépatique à l’initiation du traitement, puis tous les six mois. Au début du traitement, on observe généralement une augmentation des enzymes hépatiques ; l’arrêt du traitement n’est recommandé que si leurs valeurs dépassent deux ou trois fois la normale. Cette élévation, selon certains auteurs, n’indique pas qu’il faille arrêter le médicament : néanmoins, une surveillance étroite est recommandée.
Des effets indésirables cardiaques, notamment une bradycardie, ont été rapportés chez 5 % des patients, et des arythmies ventriculaires polymorphes (torsades de pointes) chez 1 à 2 % des patients, en particulier chez les sujets présentant des facteurs de risque pour celle-ci. Par conséquent, un ECG doit être réalisé au début du traitement, puis tous les ans. Chez les patients porteurs d’un défibrillateur cardioverteur (DAI), l’amiodarone peut augmenter la durée du cycle des tachycardies ventriculaires, ce qui peut conduire à leur détection et interférer avec l’efficacité du dispositif (4).
Enfin, parmi les autres effets indésirables mineurs, près de 100 % des patients recevant ce médicament pendant plus de six mois présentent des micro-dépôts cornéens. Leur présence ne nécessite pas l’arrêt du traitement car ils ne sont pas liés à une baisse de l’acuité visuelle. Les réactions oculaires, telles que névrite optique, atrophie avec perte de la vision ou les deux, sont plus graves, mais elles sont rares et il n’y a pas de causalité prouvée de l’amiodarone à leur égard. Une évaluation ophtalmologique n’est indiquée qu’en cas de déficit visuel.
Les autres effets secondaires rapportés sont la photosensibilité et la pigmentation bleue de la peau, qui disparaissent après l’arrêt du traitement. Chez notre patient, après avoir effectué différents tests et suspecté que le tableau clinique du patient correspondait à un TPA, l’amiodarone a été interrompu et une corticothérapie a été initiée (dose quotidienne de 40-60 mg pendant six mois vers le bas). Avec ce traitement, le patient a connu une récupération clinique et radiologique satisfaisante.
Enfin, l’amiodarone peut provoquer une hypotension chez environ 15 % des patients qui la reçoivent par voie intraveineuse. L’hypotension peut être traitée initialement en diminuant le débit de perfusion.
Figure 1A. Radiographies postéro-antérieures du thorax prises au moment de la présentation clinique et après trois mois de traitement. L’amiodarone infiltre les champs pulmonaires basaux bilatéraux alvéolointerstitiels ; toutefois, les milieux ont disparu lors du suivi (image plus bas).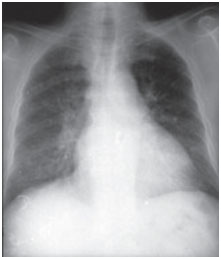
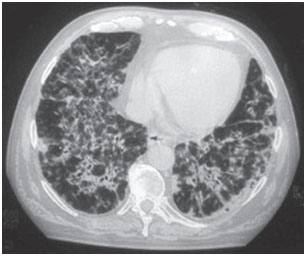
Figure 1B. Tomographie assistée par ordinateur du thorax- chez le même patient, échantillon infiltré alvéolointerstitiel bilatéral et diffus avec zones de bronchogramme aérien.
.