La servo-ventilation adaptative (ASV) est une thérapie ventilatoire non invasive qui fournit une pression positive inspiratoire (IPAP) variable pour soutenir l’inspiration lorsque l’amplitude respiratoire est réduite, assure une respiration suffisante lorsque l’effort respiratoire est absent et fournit une PAP end-expiratoire (EPAP) fixe ou variable pour maintenir la perméabilité des voies aériennes supérieures. Cette approche est conçue pour imiter la PAP nasale continue (CPAP) en termes d’ouverture pneumatique des voies aériennes supérieures et pour supprimer directement les apnées centrales du sommeil sans provoquer de surventilation.1 Dans les apnées centrales du sommeil (ACS) hypocapniques, où l’hyperventilation joue un rôle majeur, il a été démontré que l’ASV augmente légèrement les niveaux de dioxyde de carbone chez les patients souffrant d’insuffisance cardiaque (IC).1
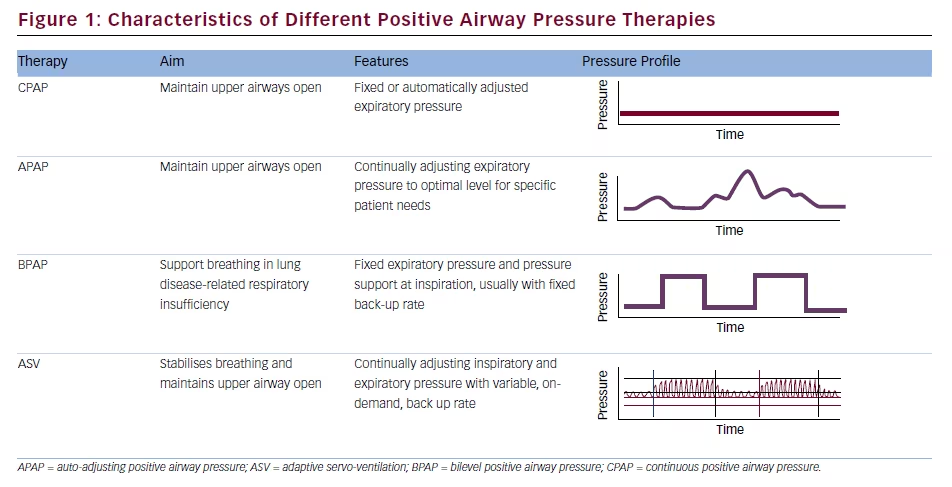
Le profil de pression fourni par les appareils ASV diffère de celui des autres thérapies PAP (voir figure 1). Bien que des réglages par défaut soient disponibles, la titration individualisée par le laboratoire du sommeil pour chaque patient est plus appropriée,2 et la meilleure approche pour maintenir le confort du patient, maximiser l’adhésion et préserver l’hémodynamique est d’utiliser les réglages efficaces minimums pour l’IPAP, l’EPAP et le débit de secours.3
Dernières données d’essai sur la servoventilation adaptative
En général, les données sur l’utilisation des appareils ASV proviennent d’études de petite taille et/ou non contrôlées et principalement de cliniques du sommeil. Cela a changé récemment avec la publication des résultats de l’essai SERVE-HF.4
SERVE-HF a été le premier essai de phase IV multicentrique international, randomisé, contrôlé, à long terme, conçu pour étudier les effets de l’ajout de la VAS à une prise en charge médicale basée sur des directives, par rapport à une prise en charge médicale seule (contrôle), sur la survie et les résultats cardiovasculaires chez les patients atteints d’HF symptomatique et de fraction d’éjection (FE) réduite (HFrEF ; FE ≤45 %) qui présentaient une VAS prédominante. La capacité du traitement par ASV à réduire significativement l’indice d’apnée-hypopnée (IAH) et à améliorer la saturation en oxygène et d’autres paramètres de troubles respiratoires du sommeil (TSD) a été confirmée dans l’étude SERVE-HF, mais ces effets ne se sont pas traduits par une amélioration des résultats cliniques4.
De manière inattendue, les résultats de l’essai étaient neutres pour le critère d’évaluation principal – premier événement du composite de décès de toute cause, d’une intervention cardiovasculaire de sauvetage (définie comme une transplantation cardiaque,
implantation d’un dispositif d’assistance ventriculaire à long terme, réanimation après un arrêt cardiaque soudain ou choc approprié pour une arythmie ventriculaire chez les patients ayant un défibrillateur cardioverteur implanté) ou une hospitalisation non planifiée pour une aggravation de l’HF – avec un hazard ratio (HR) de 1.L’identification d’un signal de sécurité dans le groupe ASV est peut-être encore plus surprenante, les patients traités par le dispositif présentant un risque plus élevé de décès toutes causes confondues (HR 1,28, 95 % CI 1,06, 1,55 ; p=0,01) et cardiovasculaires (HR 1,34, 95 % CI 1,09, 1,65 ; p=0,006). Aucune différence significative n’a été constatée entre le groupe ASV et le groupe témoin en ce qui concerne les symptômes, la capacité d’exercice ou la qualité de vie. Les effets de l’ASV sur les gaz du sang, la FE du ventricule gauche et les biomarqueurs sont en cours d’évaluation dans la sous-étude majeure SERVE-HF (NCT01164592)5, dont les résultats seront bientôt disponibles. De telles données pourraient permettre de mieux expliquer les principaux résultats de SERVE-HF.
Bien que les résultats de SERVE-HF représentent un changement de paradigme pour l’ASV, ils ne s’appliquent qu’à un sous-ensemble de patients traités par ASV (c’est-à-dire ceux atteints d’HFrEF et de CSA prédominant), et il n’y a pas de preuves suggérant la nécessité d’arrêter complètement d’envisager ce traitement. L’ASV a été étudié dans d’autres indications, et les preuves qui s’accumulent suggèrent que l’ASV pourrait avoir un rôle dans un certain nombre de groupes de patients en dehors de ceux atteints d’HFrEF.
Servo-ventilation adaptative dans l’insuffisance cardiaque avec fraction d’éjection préservée
Bien que l’impact pronostique négatif de l’HF avec FE préservée (HFpEF) soit similaire à celui de l’HFrEF,6 les deux formes d’HF représentent des syndromes cliniques différents et doivent donc être étudiées et traitées séparément.7 L’HFpEF est plus fréquente chez les femmes et a plus souvent une étiologie non-ischémique,6,8 et il n’existe actuellement aucun traitement fondé sur des preuves8. En outre, il existe des différences importantes entre l’HFpEF et l’HFrEF en ce qui concerne l’acuité et l’étendue de la dysfonction myocardique, les modèles de remodelage dans les cavités cardiaques et au niveau ultrastructurel, et la réponse aux interventions thérapeutiques.7 En raison de ces différences, on s’attendrait à ce que les résultats pendant le traitement par ASV chez les patients atteints d’HFpEF soient différents de ceux de la population de l’étude SERVE-HF qui souffrait d’HFrEF.
Les résultats de deux études à petite échelle9,10 avec des périodes de suivi de 12 et 18 mois, respectivement, suggèrent que les effets bénéfiques de l’ASV chez les patients atteints d’HFpEF pourraient s’étendre au-delà des améliorations de l’IAH et des paramètres du sommeil. Dans une étude, des patients atteints d’HFpEF présentant une respiration de Cheyne-Stokes (RSC) et traités par ASV (n=39) ont été comparés à des patients similaires ayant refusé l’ASV pour diverses raisons (n=21) sur une période de suivi de 3-24 (moyenne 11,6) mois.9 Les résultats de l’étude du sommeil ont montré que l’ASV réduisait significativement l’IAH, les apnées et hypopnées les plus longues et la désaturation maximale par rapport aux contrôles. En outre, lors des tests d’exercice cardio-pulmonaire, les patients du groupe ASV par rapport au groupe témoin présentaient des augmentations significatives de la consommation maximale d’oxygène (valeur absolue et pourcentage prédit), de la consommation d’oxygène au seuil aérobie-anaérobie et du pouls d’oxygène. Des diminutions significatives du diamètre de l’oreillette gauche et de la vitesse d’entrée mitrale Doppler précoce de pointe (E)/vitesse d’entrée mitrale Doppler atriale de pointe (A), plus des augmentations significatives de A, de la vitesse d’allongement diastolique précoce moyenne (e’) et de E/e’ ont également été rapportées.
Dans une étude randomisée ayant inclus 36 patients atteints d’HFpEF stable avec SDB central, le taux d’événements cardiaques a été comparé entre les patients ayant reçu un traitement médical optimisé seul et un traitement médical optimisé plus ASV (suivi moyen de 543 jours). Un événement cardiaque a été défini comme un décès d’origine cardiaque ou une réhospitalisation pour décompensation de l’HF. Sur une période de 6 mois de traitement, les patients atteints d’HFpEF du groupe ASV ont eu un taux sans événement plus élevé (94,4 %) que ceux du groupe sans ASV (61,1 % ; p10). Des améliorations significativement plus importantes par rapport aux valeurs initiales ont également été documentées dans les niveaux de peptide natriurétique de type B et dans la classe fonctionnelle de la New York Heart Association (NYHA) dans le groupe ASV par rapport au groupe sans ASV, mais il n’y a pas eu de changement significatif dans la FE du ventricule gauche déterminée par échocardiographie entre les valeurs initiales et les 6 mois. Du point de vue du SDB, les réductions de l’IAH par rapport au début de l’étude étaient de 30,2/h dans le groupe ASV contre 8.2/h dans le groupe sans ASV (p10
Il est possible que l’augmentation du taux de mort cardiaque subite associée au traitement par ASV de la CSA chez les patients atteints d’HFrEF identifiée dans SERVEHF4 puisse être différente dans l’HFpEF, où le risque sous-jacent de mort cardiaque subite
moins élevé. Cependant, des études à long terme plus importantes avec des résultats cliniques durs (par exemple, la mortalité) sont nécessaires pour répondre définitivement à cette question. Jusqu’à ce que de telles données soient disponibles, la décision d’utiliser ou non l’ASV pour le traitement de l’ASC chez les patients atteints d’HFpEF doit être prise au cas par cas, avec une prise en charge par un cardiologue (voir ci-dessous la recommandation sur la surveillance du traitement par ASV).
Traitement par servo-ventilation adaptative dans l’apnée du sommeil
Apnée centrale du sommeil apparue au cours du traitement
L’ASC apparue au cours du traitement, auparavant appelée apnée complexe du sommeil, survient chez environ 5 à 15 % des patients qui subissent un titrage de PAP pour une apnée obstructive du sommeil (SAOS). La définition de l’ASC apparue au cours du traitement est la persistance ou l’émergence d’apnées et d’hypopnées centrales lors de l’initiation d’un traitement par PPC sans fréquence respiratoire de secours pour le SAOS, malgré une résolution significative des événements respiratoires obstructifs.11 Pour la plupart des patients, l’ASC apparue au cours du traitement est un phénomène transitoire qui n’est pas stable dans le temps.12-14 Une explication possible est que la fragmentation du sommeil et les changements de stade du sommeil associés à la titration de la PPC provoquent une instabilité du contrôle ventilatoire. D’autres facteurs prédisposants pourraient être la présence d’une maladie coronarienne, des apnées centrales préexistantes, la gravité du SAOS et l’utilisation d’opioïdes.12,14 Cependant, un traitement est nécessaire pour le sous-groupe de patients présentant une CSA apparue au cours du traitement et qui persiste pendant l’utilisation continue de la CPAP ou de la PAP à deux niveaux (biPAP) sans fréquence de secours. Dans de tels contextes, l’ASV est le traitement le plus approprié.
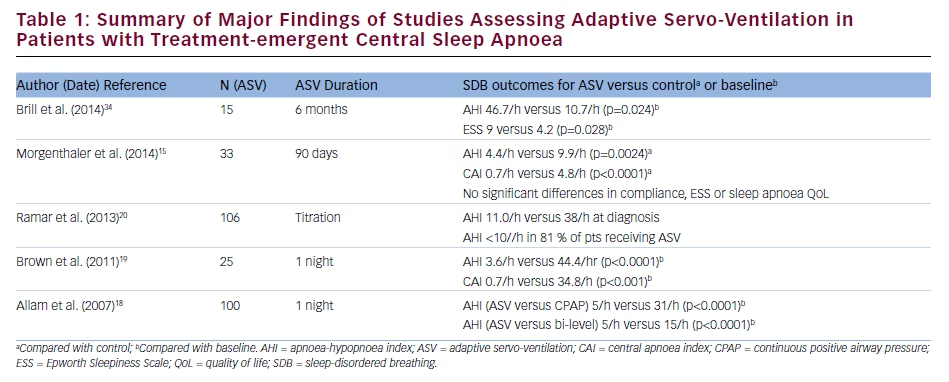
Les effets de l’ASV sur les résultats cliniques et de la polysomnographie (PSG) chez les patients présentant une CSA apparue en cours de traitement ont été comparés à ceux de la CPAP dans un essai clinique prospectif et randomisé portant sur 66 patients15. Après deux nuits de titration, l’IAH était de 5,7/h dans le groupe ASV contre 14,1/h dans le groupe CPAP (p≤0,0003) ; les valeurs correspondantes après 90 jours de traitement étaient de 4,4/h et 9,9/h (p=0,0024). L’ICA après titrage était de 1,1/h avec l’ASV et de 8,8/h avec la PPC (p≤0,0003) ; les valeurs correspondantes après 90 jours étaient respectivement de 0,7/h et de 4,8/h (p16 Les effets bénéfiques de l’ASV dans un essai observationnel prospectif multicentrique portant sur 27 patients atteints de CSA ou de CSA en cours de traitement comprenaient des améliorations de l’IAH, de l’ICA, de l’indice d’apnée obstructive et de l’indice d’éveil pendant le titrage du traitement, changements qui se sont maintenus pendant 3 mois de traitement17. En outre, on a observé une réduction significative du score de l’échelle de somnolence d’Epworth (ESS) pendant l’ASV (de 12,8 au départ à 7,8 ; p=0,001) ; l’adhésion moyenne à l’ASV était de 4,2 h/nuit. Ces données sont corroborées par les résultats d’analyses rétrospectives montrant que l’ASV est plus efficace que d’autres thérapies de PAP en ce qui concerne la réduction de l’IAH et l’amélioration de la qualité du sommeil chez les patients souffrant d’ASC en cours de traitement.18-20 Un résumé des résultats des études portant sur l’utilisation de l’ASV chez les patients présentant une CSA apparue sous traitement est présenté dans le tableau 1.
Respiration de Cheyne-Stokes induite par les opioïdes
Des apnées centrales ont été détectées à l’aide de la PSG chez 17 à 24 % des patients recevant un traitement opioïde à long terme pour des douleurs chroniques21,22. Le traitement par ASV s’est avéré améliorer les SDB chez les utilisateurs d’opioïdes dans un certain nombre d’études cliniques, et le résultat d’une méta-analyse a montré que le traitement par ASV chez les patients souffrant de CSA liés aux opioïdes a permis à 58 % des patients d’atteindre un ICA de 23
Des réductions cliniquement significatives de l’IAH, de l’ICA et de l’indice d’hypopnée ont été observées après seulement 1 nuit d’utilisation d’ASV chez des patients recevant un traitement opioïde à long terme pour des douleurs non-malignes et présentant une CSA dans une étude prospective multicentrique ; Ces améliorations ont été maintenues pendant 3 mois de traitement par ASV à domicile.24 Des réductions à court et à long terme de l’IAH et de l’ICA pendant le traitement par ASV ont également été documentées dans une autre étude sur les CSA associés aux opioïdes, et l’adhésion à long terme au traitement par ASV dans ce contexte était bonne (moyenne de 5,1 h/nuit sur une période de suivi de 9 mois à 6 ans).25 La proportion de répondeurs semble également être élevée, 59,6 % atteignant un IAH de 26 L’ASV peut également avoir la capacité d’améliorer les apnées obstructives dans ce contexte27.
Des données comparatives montrent que l’ASV est plus efficace pour réduire les apnées centrales chez les utilisateurs chroniques d’opioïdes que la biPAP et la CPAP. Dans un petit groupe de bénéficiaires chroniques d’opioïdes qui n’ont pas eu d’amélioration de l’apnée du sommeil pendant une nuit de traitement par CPAP, l’utilisation de l’ASV pendant une nuit a complètement éliminé les apnées centrales et obstructives et a réduit l’indice d’hypopnée à 13/h, par rapport à un IAH de 70/h au départ et de 55/h pendant la CPAP28. Dans une autre étude, les valeurs de l’IAH et de l’ICA étaient significativement
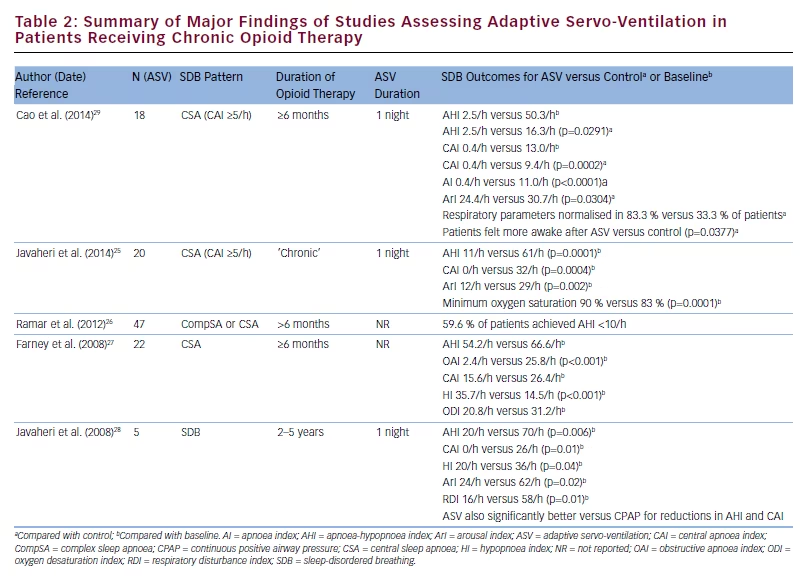
inférieures lors de l’utilisation à court terme de l’ASV par rapport à la biPAP en mode temporisé spontané (biPAP-ST) (2,5/h contre 16.3/h ; p=0,0005 et 0,4/h contre 9,4/h ; p=0,0002, respectivement).29 Dans cet essai prospectif croisé, la proportion de patients dont les paramètres respiratoires se sont normalisés était de 83,3 % pendant l’ASV et de 33.3 % pendant le traitement par bilevel-ST, et les scores du Morning After Patient Satisfaction Questionnaire ont montré que les patients se sentaient plus éveillés après le traitement par ASV par rapport au traitement par bilevel-ST (p=0,0337).29 Les résultats des études portant sur l’utilisation de l’ASV chez les patients atteints d’apnée du sommeil recevant un traitement opioïde à long terme sont résumés dans le tableau 2.
Respiration de Cheyne-Stokes idiopathique
Dans certains cas, malgré des investigations approfondies, aucune cause évidente de CSA-CSR n’est trouvée et on parle alors de CSR idiopathique, dont la prévalence exacte est inconnue. La faisabilité de l’utilisation de l’ASV pour traiter la RSC idiopathique a été évaluée chez trois patients qui n’avaient pas bien répondu à la CPAP et à l’oxygénothérapie. Le traitement par ASV a permis de réduire l’indice des événements anormaux de 35,2/h à 3,5/h, ainsi que le nombre d’éveils (18,5/h à 1,1/h). Il est important de noter que le suivi à 6-12 mois a montré une amélioration significative de la vigilance diurne et de l’humeur chez les bénéficiaires de l’ASV.30
L’apnée du sommeil après un accident vasculaire cérébral ischémique
La DB peut être documentée chez 50 % à 70 % des patients après un accident vasculaire cérébral ischémique aigu31,32 et persiste au-delà de la période aiguë chez une proportion substantielle de patients.33 Le rôle de l’ASV dans le traitement de la persistance de l’ASC après un accident vasculaire cérébral ischémique aigu a été étudié chez 15 patients, dont 13 avaient auparavant été traités sans succès par CPAP ou biPAP.34 L’IAH était de 46,7/h au départ, et a diminué à 8,5/h (p=0,001) et 10,7/h (p=0,024) après 3 et 6 mois d’ASV, respectivement. L’ASV a également amélioré la somnolence diurne, avec une diminution du score ESS de 8,6 au départ à 5,6 pendant l’ASV (p=0,08). Chez les patients qui ont utilisé l’ASV pendant ≥5 h/nuit, le score ESS a diminué de 9,0 au départ à 4,2 (p=0,028). L’utilisation de l’ASV pendant l’essai a été bonne, avec une moyenne de 5 heures 20 minutes par nuit à 3 mois et de 6 heures 22 minutes par nuit à 6 mois. L’ASV a également été bien toléré et aucun effet secondaire grave n’a été signalé.
Quand ne pas utiliser la servo-ventilation adaptative
Comme cela a toujours été le cas, l’ASV ne doit pas être utilisé dans toute situation où une hypoventilation est présente à l’état basal. Par conséquent, les gaz du sang doivent être vérifiés avant le début du traitement, comme pour toute autre stratégie de ventilation. En outre, sur la base des résultats de l’étude SERVE-HF, la VAA est désormais contre-indiquée chez les patients atteints d’HFrEF (FE du ventricule gauche inférieure ou égale à 45 %) et de CSA prédominant. Tout bénéficiaire actuel d’ASV qui répond à ces critères doit être informé des résultats de l’étude SERVE-HF et de leurs implications et passer à un autre mode de traitement.
Surveillance du traitement
Il n’existe actuellement aucune directive publiée sur la surveillance et le suivi des patients pendant le traitement par ASV. Par conséquent, les médecins doivent faire appel à leur expérience de la pratique clinique et à leur bon sens. Avant l’instauration du traitement, il semble approprié de vérifier l’absence de symptômes d’HF, d’examiner attentivement les antécédents médicaux du patient (en accordant une attention particulière aux événements cardiaques) et, en cas de doute, de déterminer la FE du ventricule gauche par échocardiographie (en particulier chez les patients susceptibles de présenter une maladie cardiovasculaire). Le suivi à court terme doit consister à vérifier les fuites, les effets secondaires et l’adhésion au traitement. L’évaluation de l’efficacité du traitement par polygraphie ou PSG après 1 à 3 mois, et un suivi à 6 mois consistant en un entretien clinique, un téléchargement de la machine et une évaluation clinique complète semblent raisonnables. Une surveillance échocardiographique continue de la FE semble prudente lorsque l’ASV est utilisé chez des patients présentant une maladie cardiaque.
Perspective et orientations futures
Un domaine important de recherche en cours consiste à élucider les mécanismes physiopathologiques sous-jacents au signal de sécurité cardiovasculaire identifié chez les patients atteints d’HFrEF traités par ASV dans l’étude SERVE-HF. Cela permettra d’identifier des sous-groupes spécifiques de patients atteints d’insuffisance cardiaque haute intensité chez lesquels l’ASV devrait être évité, et d’autres qui pourraient bénéficier du traitement par ASV. Les données issues de la sous-étude majeure SERVE-HF5 et de l’analyse du traitement, de l’essai ADVENT-HF (NCT01128816) et des registres en cours, tels que l’étude de cohorte française multicentrique et prospective FACE35, devraient permettre de mieux comprendre l’utilisation des ASV dans des sous-groupes de patients atteints d’insuffisance respiratoire aiguë (IRA) avec CSA, de patients atteints d’IRA et de SAOS ou de SAOS avec CSA coexistant et de patients atteints d’insuffisance respiratoire aiguë (IRA) avec les deux formes de SDB. Les effets de l’ASV chez les patients atteints d’HF décompensée aiguë sont étudiés dans l’étude CAT-HF (NCT01953874). En dehors de l’HF, davantage de données sont nécessaires sur l’utilisation de l’ASV chez les patients présentant différents phénotypes d’ASC, notamment les apnées centrales apparues sous traitement et induites par les opiacés.
Conclusion
Il existe un certain nombre de questions sans réponse sur la place actuelle et future du traitement par ASV chez les patients présentant diverses formes de SDB. Sur la base des résultats de l’étude SERVE-HF, le traitement par ASV devrait être évité chez les patients atteints d’HFrEF et de CSA prédominant avec CSR, et lorsque l’ASV est utilisé dans d’autres indications, une surveillance étroite des patients est recommandée, en particulier dans les sous-groupes à risque de développer une HF. Cependant, les données actuellement disponibles suggèrent que l’ASV a des effets bénéfiques chez les patients présentant une ASC apparue au cours du traitement, des apnées centrales associées à un traitement opioïde à long terme sans hypoventilation alvéolaire, une RSC idiopathique, après un accident vasculaire cérébral ischémique, et chez les patients atteints d’HFpEF. Les données à long terme sur les effets de l’ASV sur la morbidité et la mortalité dans ces groupes de patients ne sont pas encore disponibles et, par conséquent, l’initiation du traitement est une décision qui doit être prise individuellement pour chaque patient, et la thérapie poursuivie seulement si le patient montre des améliorations subjectives et objectives pendant le traitement.
ADVENT-HF = The Effect of Adaptive Servo-Ventilation on Survival and Hospital Admissions in Heart Failure
CAT-HF = Cardiovascular Improvements with MV ASV Therapy in Heart Failure
FACE = French Cohort Study of Chronic Heart Failure Patients with Central Sleep Apnoea Eligible for Adaptive Servo-.Ventilation
SERVE-HF = Traitement des troubles respiratoires du sommeil avec apnée centrale du sommeil prédominante par servo-ventilation adaptative chez les patients atteints d’insuffisance cardiaque