Voor het eerst ontdekt in 1961 en tot in de jaren ’70 werd amiodaron gebruikt voor zijn antiaritmische eigenschappen, hoewel niet officieel vóór het jaar 1985, toen de Verenigde Staten het gebruik ervan eindelijk goedkeurden. De Food and Drug Administration (FDA) was terughoudend geweest om het geneesmiddel goed te keuren wegens de eerste rapporten die een verhoogde incidentie van nadelige pulmonaire effecten aantoonden. Europese farmaceutische bedrijven begonnen midden jaren ’80 met de instelling te discussiëren en dreigden hun (gratis) levering van het geneesmiddel aan Amerikaanse artsen op te schorten, indien de FDA geen officiële goedkeuring zou verlenen. De goedkeuring werd uiteindelijk in december 1985 verleend, waarmee het een van de weinige geneesmiddelen was die door de FDA werden goedgekeurd zonder voorafgaande gerandomiseerde klinische proeven.
I – Werkingsmechanisme en farmacologische effecten
De twee jodiumatomen in het amiodaronmolecuul, een benzofuraanderivaat, zijn essentieel voor zijn antiaritmische eigenschappen. Volgens de Vaughan-Williams classificatie van antiaritmica verlengt amiodaron de actiepotentiaal van fase 3 van hartcellen en heeft het ook alle elektrofysiologische kenmerken van klasse 4.
De absorptie is uiterst traag, en de biologische beschikbaarheid is ook laag en variabel. De wachttijd tussen toediening en effect kan echter worden verkort door een hoge orale of intraveneuze dosis toe te dienen.
Aan de andere kant bindt het middel zich volledig aan plasma-eiwitten en heeft het een groot verdelingsvolume. Het wordt vervolgens in de lever gemetaboliseerd. De klaring is ook laag met een geschatte eliminatiehalfwaardetijd van 30-180 dagen als gevolg van de metaboliet desethylamiodarone, waardoor de drug zich ophoopt in perifere weefsels die als reservoir fungeren vanwege hun affiniteit voor fosfolipiden in het intralisosomaal. Deze insluitingslichaampjes zijn aangetroffen in de longen, de lever, het hart, de huid, het hoornvliesepitheel en de perifere zenuwen, hetgeen de toxische effecten in vele organen verklaart en de evenredige relatie tussen toxiciteit, gebruiksduur en cumulatieve dosis.
Bij een standaard dagelijkse onderhoudsdosis van 200 mg amiodaron komt 75 mg organisch jodium vrij. Het is belangrijk te benadrukken dat de normale dagelijkse behoefte aan jodium 0,2 tot 0,8 mg is – meer dan 100 maal lager dan wat wordt toegediend met amiodaron.
Laag gedoseerd amiodaron (100-300 mg per dag) is effectief voor een grote verscheidenheid aan ventriculaire en supraventriculaire aritmieën, ook als onderdeel van een ritmecontrolestrategie voor patiënten met atriumfibrilleren, vooral als er sprake is van structurele hartziekten. Wanneer andere geneesmiddelen er niet in geslaagd zijn aritmieën onder controle te krijgen, zullen hoge doses amiodaron nodig zijn, hetgeen een toename van de incidentie van ernstige bijwerkingen met zich meebrengt.
II – Invloed van amiodarontherapie op de overleving in de klinische setting
Er zijn in de loop der tijd verschillende bijwerkingen beschreven, vooral bij chronisch gebruik. Geschat wordt dat de prevalentie van bijwerkingen in verband met de behandeling met amiodaron 15% bedraagt in het eerste jaar en 50% in geval van langdurige toediening. Bovendien moet bij 20% van de patiënten de therapie worden gestaakt wegens effecten als leverschade, problemen met de schildklierfunctie en chronische longschade, die zijn beschreven bij maximaal 1% per jaar behandeling, met een cumulatieve schade tussen 5% en 10%. Longschade is het bekendst: deze ontstaat na langdurige blootstelling aan amiodaron (2,3), maar er zijn ook meldingen van acute toxiciteit.
Hier volgen de meest frequente, neveneffecten van het middel:
a) Long
Amiodaron-geïnduceerde pulmonale toxiciteit (APT) is een van de ernstigste bijwerkingen van het gebruik. De incidentie is ongeveer 5% bij gebruik van doses van 400 mg of meer per dag.
Interessant is dat in de atriumfibrilleren follow-up onderzoek van ritme management studie (AFFIRM) een verhoogde incidentie van pulmonale toxiciteit werd gevonden bij patiënten met reeds bestaande longziekte. De mortaliteit door pulmonale oorzaken en de totale mortaliteit waren echter niet hoger bij deze patiënten, vergeleken met patiënten zonder reeds bestaande longziekte.
Het werkingsmechanisme van deze pathologie kan direct zijn door het vrijkomen van vrije radicalen, of indirect door overgevoeligheid van de patiënt. De risicofactoren geassocieerd met deze bijwerking zijn niet goed geïdentificeerd, maar kunnen verband houden met cumulatieve doses, dagelijkse doses van meer dan 400 mg, gevorderde leeftijd en onderliggende longziekte.
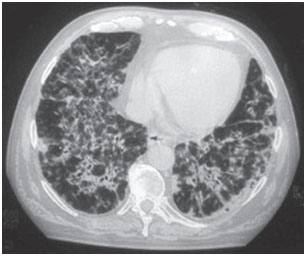
Amiodaron pulmonale toxiciteit kan zich op verschillende manieren presenteren: pneumonie interstitiële ziekte, respiratoire distress of solitaire pulmonale massa’s. Klinische scenario’s zijn variabel, de meest voorkomende symptomen zijn dyspneu en droge hoest, maar de symptomen kunnen ook koorts, gewichtsverlies, hemoptoë en pijn op de borst omvatten, die verergerd wordt door ademhalingsbewegingen. Röntgenfoto’s van de borstkas tonen onregelmatige of ongelijkmatige bilaterale interstitiële infiltraatveranderingen (figuren 1 en 2). Ademhalingsfunctietests laten een restrictief patroon zien met een verminderde en diffuse totale longcapaciteit. Het mechanisme van pulmonale toxiciteit is niet vastgesteld, maar lijkt ook dosisgerelateerd te zijn.
De diagnose van APT wordt bemoeilijkt door de aspecifieke symptomen, klinische bevindingen en resultaten van beeldvormend onderzoek en laboratoriumtests, zodat het als een uitsluitingsdiagnose wordt beschouwd. Differentiële diagnose moet worden uitgevoerd met hartfalen, longontsteking, longembolie en neoplastische ziekte. De prognose is gunstig, met een laag sterftecijfer, behalve bij patiënten die ademnood ontwikkelen, bij wie het sterftecijfer in de buurt van 50% komt. (3)
De behandeling berust op het staken van het geneesmiddel en het toedienen van corticosteroïden, die ondanks een aanvankelijk verbeterde toestand van de patiënt gedurende enkele maanden moeten worden gecontinueerd, omdat de lange halfwaardetijd van amiodaron tot een nieuwe verergering van de symptomen kan leiden. Preventie en vroegtijdige opsporing van deze mogelijke complicatie vereisen een röntgenfoto van de borstkas die bij aanvang en daarna jaarlijks wordt gemaakt.
b) Schildklier
Klinische aanwijzingen voor hypothyreoïdie komen voor bij maximaal 20% van de patiënten die amiodaron gebruiken. Amiodaron verhindert de perifere omzetting van T4 in T3 en verandert de schildklierfunctietests. De grote hoeveelheden jodium in amiodaron kunnen deze effecten verklaren.
Hypothyreoïdie is goed te behandelen met levothyroxine en is over het algemeen geen reden om te stoppen met amiodaron. Hyperthyreoïdie komt voor bij 3% van de patiënten in jodiumarme gebieden, maar bij 20% in gebieden waar voldoende jodium aanwezig is. Het kan moeilijk te herkennen zijn omdat veel van de typische, adrenerge gemedieerde verschijnselen door amiodaron worden geblokkeerd.
Bij patiënten die amiodaron gebruiken, is in de eerste maand van de behandeling een stijging van T4 (20%-40%), omgekeerd T3 (20%) en TSH te zien, en een daling van T3, die na drie maanden meestal weer normaal is.
In sommige gevallen vereiste het opnieuw optreden van atriumfibrilleren bij patiënten met amiodaron-onderhoudstherapie snelle evaluatie om door amiodaron veroorzaakte hyperthyreoïdie uit te sluiten.
Het verhoogde risico treedt op bij patiënten met een abnormale schildklierfunctie op de basislijn (auto-immuunziekte, struma) en bij ouderen. Vrouwen met positieve antithyroïd antistoffen hebben een zeven maal hoger risico op deze complicatie.
Wij adviseren een analyse van TSH, T4 en T3 bij aanvang van de behandeling, een maand na aanvang van de behandeling en daarna elke zes maanden.
De diagnose wordt gesteld bij verhoogde TSH-spiegels en verlaagde T4 en T3-spiegels. Wij willen onze lezers erop wijzen dat de stijging van het TSH gedurende de eerste drie maanden na het begin van de behandeling met amiodaron op zich geen probleem is, omdat het om een voorbijgaand verschijnsel kan gaan – de behandeling met amiodaron kan worden voortgezet mits levothyroxine wordt toegevoegd. Soms kan ook triiodothyronine worden toegevoegd als de TSH-waarden niet voldoende zijn gedaald. Behandeling vereist dan de hulp van een ervaren endocrinoloog en het staken van de behandeling met amiodaron.
Bij alle patiënten moeten de thyrotropinespiegels worden gecontroleerd voordat met amiodaron wordt begonnen en daarna elke maand.
c) Andere gebieden – gastro-intestinaal, lever, cardiaal, oogheelkundig, huid
Gastro-intestinale stoornissen zoals misselijkheid, braken, diarree, of anorexie komen vaak voor (30%) bij aanvang van de behandeling. Enkele van de meest gevreesde gastro-intestinale bijwerkingen – hepatitis en levercirrose – zijn echter zeldzaam (<3%). Het wordt aanbevolen om de leverfunctie te testen bij het begin van de behandeling, en vervolgens elke zes maanden. Bij het begin van de behandeling wordt over het algemeen een stijging van de leverenzymen waargenomen; stopzetting van de behandeling wordt niet aanbevolen, tenzij de waarden twee- of driemaal de normale waarde overschrijden. Volgens sommige auteurs is deze stijging geen indicatie om met het geneesmiddel te moeten stoppen: niettemin wordt nauwlettend toezicht aanbevolen.
Cardiale bijwerkingen, waaronder bradycardie, zijn gemeld bij 5% van de patiënten, en polymorfe ventriculaire aritmieën (torsade de pointes) bij 1%-2% van de patiënten, vooral bij personen met risicofactoren daarvoor. Daarom moet een ECG worden uitgevoerd bij aanvang van de behandeling en vervolgens jaarlijks. Bij patiënten met een cardioverter defibrillator (ICD) kan amiodaron de cycluslengte van ventriculaire tachycardieën verhogen, waardoor deze kunnen worden gedetecteerd en de effectiviteit van het apparaat kan worden verstoord (4).
Ten slotte heeft, naast andere kleine bijwerkingen, bijna 100% van de patiënten die dit geneesmiddel langer dan zes maanden krijgen, microdeposito’s in het hoornvlies. De aanwezigheid hiervan vereist geen stopzetting van de behandeling, aangezien deze geen verband houdt met een verslechtering van de gezichtsscherpte. Oculaire reacties, zoals neuritis optica, atrofie met verlies van gezichtsvermogen of beide, zijn ernstiger, maar zij zijn zeldzaam en er is geen bewezen causaliteit van amiodaron met betrekking hiertoe. Oogheelkundige evaluatie is alleen geïndiceerd als er sprake is van een visusdeficiëntie.
Andere gemelde bijwerkingen zijn lichtgevoeligheid en blauwe huidpigmentatie, die verdwijnen na het staken van de behandeling. Bij onze patiënt werd, na het uitvoeren van verschillende tests en het vermoeden dat het klinische beeld van de patiënt overeenkwam met TPA, amiodaron gestaakt en werd een behandeling met corticosteroïden gestart (een dagelijkse dosis van 40-60 mg gedurende zes maanden). Met deze behandeling kende de patiënte een bevredigend klinisch en radiologisch herstel.
Ten slotte kan amiodaron hypotensie veroorzaken bij ongeveer 15% van de patiënten die het intraveneus toegediend krijgen. Hypotensie kan in eerste instantie worden behandeld door de infusiesnelheid te verlagen.
Figuur 1A. Postero-anterieure radiografieën van de borstkas genomen op het moment van de klinische presentatie en na drie maanden behandeling. Amiodarone infiltreert alveolointerstitiële bilaterale basale longvelden; de media zijn echter verdwenen bij follow-up (beeld verder onderaan).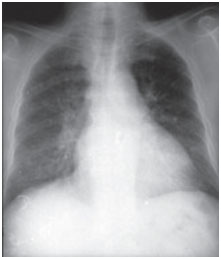
Figuur 1B. Computertomografie van de borstkas- bij dezelfde patiënt, bilateraal en diffuus alveolointerstitiële geïnfiltreerd met lucht bronchogram gebieden.