INLEIDING TOT ZURIGE ANHYDRIDEN
Deze pagina legt uit wat zure anhydriden zijn en bekijkt hun eenvoudige fysische eigenschappen, zoals kookpunten. Het introduceert hun chemische reactiviteit op een algemene manier, maar details van specifieke reacties worden op aparte pagina’s gegeven – zie het menu Zure anhydriden (link onderaan de pagina).
Wat zijn zure anhydriden?
De structuur van zure anhydriden
Een carbonzuur zoals ethaanzuur heeft de structuur:
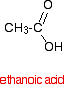
Als je twee ethaanzuurmoleculen neemt en er een watermolecuul tussenuit haalt, krijg je het zure anhydride, ethaanzuuranhydride (oude naam: azijnzuuranhydride).
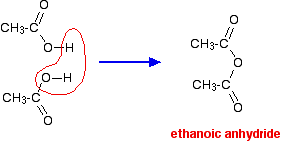
Je kunt ethaanzuuranhydride eigenlijk maken door ethaanzuur te dehydrateren, maar normaal gesproken wordt het op een efficiëntere, meer omslachtige manier gemaakt. (Het maken van ethaanzuuranhydride valt buiten het bestek van het Britse A-niveau.)
Zure anhydriden een naam geven
Dit is heel gemakkelijk. Je neemt gewoon de naam van het moederzuur, en vervangt het woord “zuur” door “anhydride”. “Anhydride’ betekent gewoon ‘zonder water’.
Dus … ethaanzuur vormt ethaanzuuranhydride; propaanzuur vormt propaanzuuranhydride, enzovoort.
Voor het Britse A-niveau is de enige die je waarschijnlijk zult tegenkomen ethaanzuuranhydride.
Fysische eigenschappen van zure anhydriden
We zullen ethaanzuuranhydride als typisch nemen.
Opzicht
Ethaanzuuranhydride is een kleurloze vloeistof, die sterk naar azijn (ethaanzuur) ruikt.
De geur komt doordat ethaanzuuranhydride reageert met waterdamp in de lucht (en vocht in je neus) om weer ethaanzuur te produceren. Deze reactie met water wordt op een andere bladzijde in detail beschreven. (Te vinden in het menu Zure anhydriden – link onderaan deze pagina.)
Oplosbaarheid in water
Ethaandizuuranhydride lost niet op in water, omdat het daarmee reageert tot ethaanzuur. Er bestaat niet zoiets als een waterige oplossing van ethaanzuuranhydride.
Kookpunt
Ethaanzuuranhydride kookt bij 140°C. Dat komt omdat het een vrij groot polair molecuul is en dus zowel van der Waals dispersiekrachten als dipool-dipool attracties heeft.
Het vormt echter geen waterstofbruggen. Dat betekent dat het kookpunt niet zo hoog is als dat van een carboxylzuur van vergelijkbare grootte. Zo kookt pentaanzuur (het zuur van vergelijkbare grootte) bij 186°C.