Een eenvoudige gids voor het begrijpen van oppervlakteactieve stoffen
TweetPrint
Wat is een oppervlakteactieve stof?
Surfactanten zijn een primair bestanddeel van schoonmaakmiddelen. Het woord oppervlakte-actieve stof betekent oppervlakte-actieve stof. Zoals de naam al doet vermoeden, zetten oppervlakteactieve stoffen het oppervlak dat u reinigt in beweging om vuil op te vangen en van het oppervlak te verwijderen.
Surfactanten hebben een hydrofobe (waterafstotende) staart en een hydrofiele (waterminnende) kop. De hydrofobe staart van elke oppervlakteactieve stof omringt het vuil. De hydrofiele kop wordt omringd door water.

Hoe werken oppervlakteactieve stoffen?
Als er een voldoende aantal moleculen van oppervlakteactieve stoffen in een oplossing aanwezig zijn, combineren ze zich tot structuren die micellen worden genoemd. Bij de vorming van de micellen positioneren de koppen van de oppervlakte-actieve stoffen zich zo dat ze aan water worden blootgesteld, terwijl de staarten in het midden van de structuur gegroepeerd zijn en tegen water worden beschermd.
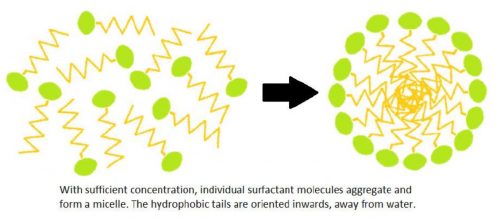
De micellen werken als een eenheid om vuil te verwijderen. De hydrofobe staarten worden aangetrokken door het vuil en omringen het, terwijl de hydrofiele koppen het omringende vuil van het oppervlak in de reinigingsoplossing trekken. Vervolgens vormen de micellen zich weer, waarbij de staarten het vuil in het midden van de structuur ophangen.

Typen oppervlakteactieve stoffen
De hydrofiele kop van elke oppervlakteactieve stof is elektrisch geladen. De lading kan negatief, positief of neutraal zijn. Afhankelijk van de lading van de hydrofiele kop wordt de oppervlakteactieve stof geclassificeerd als anionisch, niet-ionisch, kationisch of amfoteer.
Anionogene oppervlakteactieve stoffen
Anionogene oppervlakteactieve stoffen hebben een negatieve lading aan hun hydrofiele uiteinde. De negatieve lading helpt de moleculen van de oppervlakte-actieve stof de grond op te tillen en in micellen te laten zweven. Omdat ze in staat zijn een breed scala van soorten vuil aan te pakken, worden anionogene oppervlakteactieve stoffen vaak gebruikt in zepen en detergentia. Anionogene oppervlakteactieve stoffen maken veel schuim wanneer ze worden gemengd. Terwijl anionogene oppervlakte-actieve stoffen uitstekend zijn voor het opheffen en suspenderen van deeltjes, zijn ze niet zo goed in het emulgeren van olieachtige bodems.
Sulfaten, sulfonaten en gluconaten zijn voorbeelden van anionogene oppervlakte-actieve stoffen.
Nonionogene oppervlakte-actieve stoffen
Nonionogene oppervlakte-actieve stoffen zijn neutraal, ze hebben geen lading op hun hydrofiele uiteinde. Niet-ionogene oppervlakte-actieve stoffen zijn zeer goed in het emulgeren van oliën en zijn beter dan anionogene oppervlakte-actieve stoffen in het verwijderen van organische vervuiling. De twee worden vaak samen gebruikt om multifunctionele reinigingsmiddelen met dubbele werking te maken, die niet alleen deeltjes kunnen opheffen en in suspensie brengen, maar ook olieachtige verontreinigingen kunnen emulgeren.
Zekere niet-ionogene oppervlakteactieve stoffen kunnen niet-schuimend of laagschuimend zijn. Dit maakt ze een goede keuze als ingrediënt in laagschuimende detergentia.
Nonionogene oppervlakteactieve stoffen hebben een unieke eigenschap, het zogenaamde troebelingspunt. Het troebelingspunt is de temperatuur waarbij de niet-ionogene oppervlakteactieve stof zich begint te scheiden van de reinigingsoplossing, de zogenaamde fasescheiding. Wanneer dit gebeurt, wordt de reinigingsoplossing troebel. Dit wordt beschouwd als de temperatuur voor optimale detergentie. Voor laagschuimende reinigingsmiddelen ligt de optimale detergentie bij het wolkpunt; voor schuimende reinigingsmiddelen ligt de optimale detergentie ofwel net onder het wolkpunt of bij het begin van het wolkpunt. De agitatie van laagschuimende reinigingsmiddelen is voldoende om fasescheiding te voorkomen.
De temperatuur van het wolkpunt hangt af van de verhouding tussen de hydrofobe en hydrofiele delen van de niet-ionogene oppervlakteactieve stof. Sommige wolkenpunten liggen bij kamertemperatuur, terwijl andere zeer hoog liggen. Sommige niet-ionogene oppervlakteactieve stoffen hebben geen troebelingspunt omdat ze een zeer hoge verhouding hydrofiel-hydrofoob hebben.
Voorbeelden van enkele veelgebruikte niet-ionogene oppervlakteactieve stoffen zijn ethoxylaten, alkoxylaten en cocamiden.
Kationogene oppervlakteactieve stoffen
Kationogene oppervlakteactieve stoffen hebben een positieve lading aan hun hydrofiele uiteinde. De positieve lading maakt ze nuttig in antistatische producten, zoals wasverzachters. Kationogene oppervlakteactieve stoffen kunnen ook dienen als antimicrobiële stoffen, dus worden ze vaak gebruikt in ontsmettingsmiddelen.
Kationogene oppervlakteactieve stoffen kunnen niet worden gebruikt met anionogene oppervlakteactieve stoffen. Indien positief geladen kationogene oppervlakteactieve stoffen worden gemengd met negatief geladen anionogene oppervlakteactieve stoffen, zullen zij uit de oplossing vallen en niet langer effectief zijn. Kationogene en niet-ionogene oppervlakteactieve stoffen zijn echter wel compatibel.
Voorbeelden van enkele veelgebruikte kationogene oppervlakteactieve stoffen zijn alkylammoniumchloriden.
Amfotere oppervlakteactieve stoffen
Amfotere oppervlakteactieve stoffen hebben een dubbele lading aan hun hydrofiele uiteinde, zowel positief als negatief. De dubbele lading heft elkaar op, waardoor een nettolading van nul ontstaat, zwitterionisch genoemd. De pH van een gegeven oplossing zal bepalen hoe de amfotere oppervlakteactieve stoffen reageren. In zure oplossingen worden de amfotere oppervlakte-actieve stoffen positief geladen en gedragen ze zich als kationogene oppervlakte-actieve stoffen. In alkalische oplossingen krijgen ze een negatieve lading, vergelijkbaar met anionogene oppervlakteactieve stoffen.
Amfotere oppervlakteactieve stoffen worden vaak gebruikt in producten voor persoonlijke verzorging, zoals shampoos en cosmetica. Voorbeelden van enkele veelgebruikte amfotere oppervlakte-actieve stoffen zijn betaïnes en amino-oxides.
Hoe oppervlakte-actieve stoffen worden gebruikt in schoonmaakmiddelen
Surfactanten zijn een belangrijk ingrediënt in schoonmaakmiddelen. Schoonmaakmiddelen onderscheiden zich onder meer door de manier waarop ze worden gemaakt. Schoonmaakmiddelen die van één chemische stof zijn gemaakt en op een specifiek soort vuil zijn gericht, worden standaardschoonmaakmiddelen genoemd. Schoonmaakmiddelen die bestaan uit een mengsel van verschillende chemische ingrediënten die zijn ontworpen om samen verschillende soorten vuil te verwijderen, worden geformuleerde schoonmaakmiddelen genoemd.
Geformuleerde schoonmaakmiddelen bevatten gewoonlijk vier basiselementen: oppervlakteactieve stoffen, hydrotrope stoffen, bouwstoffen en draagstoffen. Hydrotrope stoffen zijn chemicaliën die de anders onverenigbare oppervlakteactieve stoffen en bouwstoffen stabiel houden in een oplossing. De draagstof is water of een oplosmiddel. Deze elementen werken samen om mechanische acties te creëren om vuil te verwijderen. Het eindresultaat is een product dat vuil op oppervlakken kan aanpakken met een verscheidenheid aan reinigingsmechanismen, waaronder emulgeren, opheffen, dispergeren, sekwestreren, suspenderen en afbreken van vuil van verschillende soorten. Het type oppervlakte-actieve stoffen dat in een reinigingsproduct wordt gebruikt, bepaalt in grote mate welke vervuilingen het best worden verwijderd.
IPC biedt een volledige lijn van geformuleerde reinigingsmiddelen die behoren tot de veiligste en meest effectieve oplossingen op de markt. Vraag een gratis monster aan om onze producten te testen voor uw meest uitdagende schoonmaaktoepassingen.

TweetPrint