
Er zit heel wat chemie en fysica achter de schoonheid en het licht van een kaarsvlam. Wetenschappers zijn al honderden jaren gefascineerd door kaarsen.
In 1860 gaf Michael Faraday zijn nu beroemde lezingenreeks over de chemische geschiedenis van een kaars, waarin hij tientallen wetenschappelijke principes demonstreerde aan de hand van zijn nauwkeurige observaties van een brandende kaars.
In de late jaren 1990 bracht NASA het onderzoek naar kaarsen naar nieuwe hoogten, door experimenten in de space shuttle uit te voeren om meer te leren over het gedrag van kaarsvlammen in microzwaartekracht.
Wetenschappers in universiteiten en onderzoekslaboratoria over de hele wereld voeren nog steeds experimenten uit met kaarsen om meer te leren over kaarsvlammen, emissies en verbranding.
En natuurlijk onderzoeken duizenden leerlingen elk jaar de principes van warmte, licht en verbranding via wetenschappelijke schoolprojecten met kaarsen.
Klik hier voor ideeën voor wetenschappelijke projecten & Tips
Hoe kaarsen branden
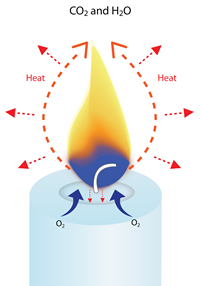
Alle wassen zijn in wezen koolwaterstoffen, wat betekent dat ze grotendeels bestaan uit waterstofatomen (H) en koolstofatomen (C).
Als je een kaars aansteekt, smelt de hitte van de vlam de was bij de pit. Deze vloeibare was wordt vervolgens door capillaire werking naar boven getrokken.
De hitte van de vlam verdampt de vloeibare was (verandert deze in een heet gas), en begint de koolwaterstoffen af te breken in moleculen van waterstof en koolstof. Deze verdampte moleculen worden in de vlam gezogen, waar ze met zuurstof uit de lucht reageren tot warmte, licht, waterdamp (H2O) en kooldioxide (CO2).
Bijna een vierde van de energie die door de verbranding van een kaars wordt opgewekt, wordt afgegeven in de vorm van warmte die vanuit de vlam in alle richtingen straalt.
Er ontstaat genoeg warmte om terug te stralen en meer was te smelten om het verbrandingsproces gaande te houden totdat de brandstof is opgebruikt of de warmte is verdwenen.
Het duurt een paar minuten als u voor het eerst een kaars aansteekt, voordat dit verbrandingsproces zich stabiliseert. De vlam kan in het begin een beetje flikkeren of roken, maar als het proces eenmaal is gestabiliseerd, zal de vlam schoon en gestaag branden in een rustige traanvorm, waarbij kooldioxide en waterdamp vrijkomen.
Een rustig brandende kaarsvlam is een zeer efficiënte verbrandingsmachine. Maar als de vlam te weinig of te veel lucht of brandstof krijgt, kan ze flakkeren of flakkeren en zullen onverbrande koolstofdeeltjes (roet) uit de vlam ontsnappen voordat ze volledig kunnen ontbranden.
De rookpluim die je soms ziet als een kaars flakkert, wordt eigenlijk veroorzaakt door onverbrande roetdeeltjes die uit de vlam zijn ontsnapt als gevolg van een onvolledige verbranding.
Klik hier voor onderzoek naar kaarsen
De kleuren van een kaarsvlam
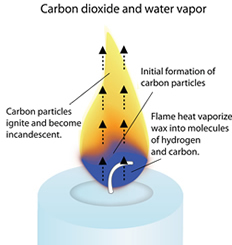
Als je goed naar een kaarsvlam kijkt, zie je een blauw gebied aan de basis van de vlam. Daarboven bevindt zich een klein donker oranjebruin gedeelte, en daarboven bevindt zich het grote gele gebied dat we met kaarsvlammen associëren.
De zuurstofrijke blauwe zone is waar de koolwaterstofmoleculen verdampen en uiteen beginnen te vallen in waterstof- en koolstofatomen. De waterstof splitst zich hier als eerste af en reageert met de zuurstof tot waterdamp. Een deel van de koolstof verbrandt hier en vormt kooldioxide.
Het donkere of oranje/bruine gebied heeft relatief weinig zuurstof. Hier worden de verschillende vormen van koolstof verder afgebroken en beginnen zich kleine, verharde koolstofdeeltjes te vormen.
Zodra ze opstijgen, samen met de waterdamp en kooldioxide die in de blauwe zone zijn ontstaan, worden ze verhit tot ongeveer 1000 graden Celsius.
Aan de onderkant van de gele zone neemt de vorming van de koolstofdeeltjes (roet) toe. Terwijl ze opstijgen, blijven ze verhitten totdat ze ontbranden tot gloeiing en het volledige spectrum van zichtbaar licht uitstralen. Omdat het gele gedeelte van het spectrum het meest dominant is wanneer de koolstof ontbrandt, neemt het menselijk oog de vlam als gelig waar. Wanneer de roetdeeltjes in de buurt van de top van de gele zone van de vlam oxideren, bedraagt de temperatuur ongeveer 1200o C.
De vierde zone van de kaars (soms de sluier genoemd) is de vage buitenste blauwe rand die zich uitstrekt van de blauwe zone aan de basis van de vlam en langs de zijkanten van de vlamkegel omhoog loopt. Het is blauw omdat het direct in contact komt met de zuurstof in de lucht, en het is het heetste deel van de vlam, meestal tot 1400o C (2552o F).
Waarom een kaarsvlam altijd naar boven wijst
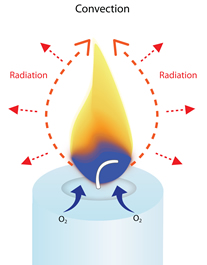
Wanneer een kaars brandt, verwarmt de vlam de nabijgelegen lucht en begint te stijgen. Terwijl deze warme lucht omhoog stroomt, stromen koelere lucht en zuurstof aan de onderkant van de vlam naar binnen om deze te vervangen.
Wanneer deze koelere lucht wordt verwarmd, stijgt ook deze op en wordt vervangen door koelere lucht aan de basis van de vlam.
Dit creëert een voortdurende cyclus van omhoog bewegende lucht rond de vlam (een convectiestroom), die de vlam zijn langwerpige of traanvormige vorm geeft.
Omdat “omhoog” en “omlaag” een functie zijn van de zwaartekracht van de aarde, vroegen wetenschappers zich af hoe een kaarsvlam er in de ruimte uit zou zien, waar de aantrekkingskracht van de zwaartekracht minimaal is en er eigenlijk geen omhoog of omlaag is.
In de late jaren negentig voerden NASA-wetenschappers verschillende spaceshuttle-experimenten uit om te zien hoe kaarsvlammen zich in microzwaartekracht gedroegen. Zoals je op de NASA-foto’s hieronder kunt zien, is een kaarsvlam in microzwaartekracht bolvormig in plaats van de langwerpige vorm op aarde. Zonder zwaartekracht is er geen “opwaartse” richting voor warme lucht om op te stijgen en een convectiestroom te creëren.

Een kaarsvlam bij normale zwaartekracht

Een kaarsvlam in microzwaartekracht
Interessante lectuur
De chemische geschiedenis van kaarsen
(lezingenreeks van Michael Faraday uit 1860 in Londen)
www.bartleby.com
Kaarsen in Microzwaartekracht
(NASA’s ruimteprogramma onderzoek naar kaarsen)
www.microgravity.gov
Kandelaar Raket Schip
(NASA’s experimenten met het gebruik van paraffinewas als raketbrandstof.)
www.science.nasa.gov
De natuurkunde en scheikunde die ten grondslag liggen aan de oneindige charme van een kaarsvlam
(Door Jearl Walker. Oorspronkelijk afgedrukt in The Amateur Scientist Column, Scientific American, april 1978.)
www.bashaar.org.il