Richtende vraag
Welke factoren bepalen hoe nauwkeurig en hoe precies de concentratie azijnzuur in azijn kan worden bepaald?
Inleiding
In veel laboratoria worden consumentenproducten geanalyseerd om de nauwkeurigheid van de etikettering van het product te bepalen. De zeer gebruikelijke en eenvoudige techniek van titratie wordt in dit experiment gedemonstreerd. Een titratie is een analytische procedure waarbij een reactie wordt uitgevoerd onder zorgvuldig gecontroleerde omstandigheden. Het stoichiometrische volume van een reactant met bekende concentratie, de titrant, dat nodig is om te reageren met een andere reactant met onbekende concentratie, de analyt, wordt gemeten. De concentratie van de analyt wordt bepaald uit de concentratie en het volume van de titrant en de stoichiometrie van de reactie tussen beide. De proefopstelling is afgebeeld in figuur 1. Een buret, die de titrant bevat, is gekalibreerd zodat het volume van de oplossing die hij afgeeft met grote nauwkeurigheid en precisie kan worden bepaald. Titrant wordt aan de analyt toegevoegd tot het stoichiometrische volume van titrant is toegevoegd. Dit wordt het equivalentiepunt genoemd, waarbij het door de buret geleverde volume titrant wordt afgelezen. Gewoonlijk worden de afgelezen volumes geschat tot op 0,01 mL nauwkeurig. De afgifte van de titrant wordt geregeld met het kraantje op de buret. Met wat oefening kan men fracties van een druppel titrant toedienen en de procedure zo goed beheersen dat herhaalde titraties binnen 0,10 mL overeenkomen. Voor dit eerste practicum moeten de titraties binnen 0,50 mL overeenkomen.
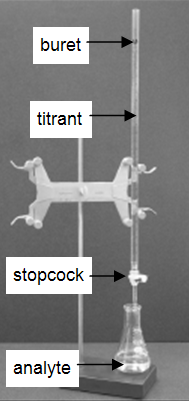
Figuur 1: Titratieopstelling
Vaak wordt het equivalentiepunt visueel bepaald met een indicator. De indicator, een stof die in de buurt van het equivalentiepunt van kleur verandert, wordt aan de analytoplossing toegevoegd. Aangezien de kleurverandering dichtbij maar niet precies op het equivalentiepunt ligt, wordt het punt waar de kleurverandering optreedt het eindpunt genoemd. Indicatoren worden zo gekozen dat het eindpunt zeer dicht bij het equivalentiepunt ligt. Het is belangrijk een titratie goed gemengd te houden, zodat de titrant en de analyt met elkaar in contact kunnen komen en snel reageren. De kolf kan met de hand worden omgeroerd of mechanisch worden geroerd. In dit experiment zul je handmatig roeren gebruiken. Het meest gebruikelijke type titratie is de zuur-base titratie. In dit experiment bepaal je de concentratie van azijnzuur, HC2H3O2 in commerciële azijn. In deze titratie is waterige NaOH de titrant, en azijn de analyt. We nemen aan dat de sterke base en het zwakke zuur volledig reageren volgens de nettovergelijking:
De evenwichtsvergelijking vertoont een 1:1 stoichiometrie, dus kunnen we schrijven:
Of meer algemeen:
Hoeveel base kan worden berekend uit molariteit maal volume
Ter herinnering over de concentratie-eenheden: molariteit is gedefinieerd als het aantal mol van de opgeloste stof in een liter oplossing (M = mol/L). Dit is numeriek gelijk aan het aantal millimol opgeloste stof in een milliliter oplossing (M = mmol/mL). Het is vaak handig om deze tweede definitie van molariteit te gebruiken bij titraties en andere werkzaamheden waarbij het om kleine hoeveelheden gaat. Er zit 1000 mmol in 1 mol en 1000 mL in 1 liter. Bijvoorbeeld, 10,2 mL 0,100 M NaOH oplossing bevat 1,02 mmol NaOH.
0.100 mmol NaOH
1 mol oplossing
= 1,02 mmol NaOH
De molariteit van het zuur kan worden berekend aan de hand van het aantal mol gedeeld door het volume
In dit experiment wordt een zorgvuldig afgemeten volume azijn
in een kolf gedaan en de massa bepaald. Het azijnmonster wordt vervolgens getitreerd met een NaOH-oplossing van bekende concentratie
en het volume NaOH-oplossing dat nodig is om het eindpunt
te bereiken, wordt bepaald.
en
zijn alle bekend, zodat de concentratie van het zuur
kan worden bepaald zoals hierboven beschreven. Bovendien kan de massa azijnzuur in het monster worden bepaald uit het aantal aanwezige mol en de molaire massa van azijnzuur
Tenslotte kan het massapercentage azijnzuur in de azijn worden bepaald uit de massa van het azijnzuur in het monster en de massa van de azijnoplossing die getitreerd is.
massa azijnzuur in monster
massa getitreerde azijnoplossing
× 100
Bij de titratie van azijnzuur met waterig NaOH wordt fenolftaleïne als indicator gebruikt. Fenolftaleïne is bijna kleurloos in zure oplossing, maar wordt roze bij een pH van ongeveer 8. Dit geeft aan dat de base al het zuur heeft geneutraliseerd. Als je de azijn titreert, zul je zien dat de roze kleur hardnekkiger wordt naarmate je meer base toevoegt. Dit is een signaal om de toevoeging van de base te vertragen en zorgvuldig te controleren. Het eindpunt is bereikt wanneer een vage roze kleur ten minste 30 seconden aanhoudt. Het is gemakkelijk om het eindpunt te overschrijden. Als dit gebeurt, krijgt u een donker paarsroze oplossing en moet u de titratie herhalen, dus wees voorzichtig. Noteer het volume dat je hebt gebruikt, stop bij volgende titraties niet verder dan dit volume en voeg de laatste milliliter druppelsgewijs toe. Je docent zal je laten zien hoe je de kraan van de buret moet bedienen om dit te vergemakkelijken. Merk op dat de volumemetingen bij titraties meestal tot vier significante cijfers worden gerapporteerd, dus de concentraties worden meestal ook tot vier significante cijfers gerapporteerd. Let hierop in je werk; als je molaire massa’s berekent, zorg er dan voor dat je vier significante cijfers hebt.
Doelen
Als je dit onderzoek afrondt, zul je:
-
1
een NaOH(aq)-oplossing standaardiseren.
-
2
Een azijnmonster titreren met de gestandaardiseerde NaOH(aq)-oplossing.
-
3
Meet de dichtheid van een azijnmonster.
-
4
Bereken de molariteit en het massapercentage azijnzuur in het azijnmonster.
Gebruiksmaterialen
- Azijn
- NaOH(aq)-oplossing
- KHP – kaliumwaterstofftalaat
- Phenolftaleïne-indicator
- 10-mL pipetten
- Bekers
- Buretstatief met buret
- Funnel
- Analytische balansen
Erlenmeyer kolven, 125 mL
Veiligheidsmaatregelen
NaOH is bijtend. Het kan de huid aantasten en blijvende schade aan de ogen veroorzaken. Als NaOH-oplossing in uw ogen spat, gebruik dan onmiddellijk het oogspoelstation. Houd uw ogen open en spoel met water. Bij contact met huid of kleding, spoel het getroffen gebied met water. Laat uw labopartner uw docent op de hoogte brengen van het gemorste product.
Getting Started
Je eerste opdracht is de NaOH-oplossing te standaardiseren met behulp van vast KHP (KC8H5O4, 204,22 g/mol). Dit betekent dat je de molariteit moet bepalen tot op ten minste drie significante cijfers. Je hebt ten minste drie titraties nodig die binnen 1% overeenkomen, zoals beschreven in de procedure. Je moet in het practicum nog twee andere taken uitvoeren. Je moet de dichtheid van de azijnoplossing bepalen en de molariteit van het azijnzuur in azijn. Het massapercentage azijnzuur kan worden berekend aan de hand van uw gegevens.Om uw taken uit te voeren, zult u zeer nauwkeurige volume- en massametingen moeten uitvoeren. Buretten en pipetten zijn handig voor het nauwkeurig meten van volumes. De buret en de pipet worden in de inleiding en in de video’s beschreven. Zorg ervoor dat je weet hoe ze gebruikt moeten worden voordat je begint.
Procedure
Print het werkblad voor dit practicum. Dit blad heb je nodig om je gegevens te noteren.

Voorbereiding van de buret
Controleer de buret door de zijkanten af te spoelen met een fles gedestilleerd water om te controleren of er waterdruppels aan de binnenkant van de buret “plakken”. Als er waterdruppels worden waargenomen, moet de buret voor gebruik worden afgewassen. Zorg ervoor dat u geen krassen maakt op het binnenoppervlak als u een buretborstel moet gebruiken om de buret schoon te maken. Spoel de buret goed om met kraanwater, inclusief de afsluitkraan en de sluitringen. Spoel vervolgens de wanden van de buret af met gedeïoniseerd/gedestilleerd water.
Spoel tenslotte de buret minstens TWEE maal met kleine porties van uw NaOH-oplossing om er zeker van te zijn dat al het water verwijderd is. Laat de oplossing door de punt naar buiten lopen.
Vul de buret met NaOH-oplossing met behulp van een trechter.
Om na het vullen de ingesloten luchtbelletjes in de punt van de buret te verwijderen, moet de stop meerdere malen snel open en dicht worden gedraaid. Opmerking: Als de stopkraan goed in lijn staat met de punt van de buret, zijn de ingesloten luchtbellen niet zo overheersend. Neem contact op met de instructeur als de luchtbel blijft bestaan.
Standaardisatie met KHP
Gebruik ~1 gram KHP. NOTEER DE MASSA ONMIDDELLIJK IN DE DATAKAART.
Gebruik de wasfles met gedestilleerd water om er zeker van te zijn dat alle monsters in de kolf zijn overgebracht.
Voeg ongeveer 50 mL gedestilleerd water en twee of drie druppels indicator toe. De indicator fenolftaleïne zal in dit titratie-experiment worden gebruikt. Gebruik niet te veel indicator, anders titreer je dat molecuul ook. Gebruik consequent hetzelfde aantal druppels in alle monsters.
Titratietechniek
Leg een vel wit papier onder de opvangkolf om het eindpunt beter te kunnen zien.
Gebruik een gespleten witte boven/zwarte onderkaart als hulpmiddel bij het aflezen van de meniscus. Door de kaart achter de buret te plaatsen en de zwarte lijn net onder de meniscus, wordt de meniscus donkerder zodat deze gemakkelijk af te lezen is. Noteer de INITIËLE VOLUME NaOH-oplossing tot op de HUNDREDE MILLILITER nauwkeurig (±0,01 ml) in de DATABEL van je OPMERKINGBOEK.
De titrant (NaOH-oplossing in buret) kan in het begin vrij snel worden toegevoegd, maar naarmate het eindpunt wordt genaderd, moet het tempo van toevoegen worden vertraagd. Als je rechtshandig bent, is het sneller om de titrant met je linkerhand toe te voegen terwijl je met rechts zwenkt (vice versa voor linkshandigen). Naarmate het eindpunt nadert, zal de roze kleur steeds langer aanhouden. Spoel in de buurt van het eindpunt de wand van de kolf af met gedestilleerd water om er zeker van te zijn dat alle toegevoegde NaOH base heeft gereageerd.
Wanneer het eindpunt zeer dicht is genaderd, laat men een halve druppel base op het uiteinde van de buret vallen en spoelt men de druppel met de wasfles met gedestilleerd water in de opvangkolf. Een andere methode om een fractie van een druppel toe te voegen is de kraan zeer snel 180 graden te draaien; je kunt echter onbedoeld te veel base toevoegen als je deze techniek verkeerd toepast.
Het eindpunt treedt op wanneer de fenolftaleïne verandert van helder naar de zwakste roze kleur die je kunt zien en die minimaal 30 seconden aanhoudt. Noteer de uiteindelijke hoeveelheid NaOH-oplossing tot op de naaste honderdste milliliter (± 0,01 ml) in de gegevenstabel. Bepaal vervolgens de hoeveelheid NaOH-oplossing die bij de titratie is gebruikt.
Je groep moet MINIMAAL VIER PROEVEN doen en drie proeven moeten overeenkomen ZONDER ±1%. U mag er meer doen, afhankelijk van uw techniek. U KUNT NIET ZOMAAR GEGEVENS “WEGSTREPEN” OMDAT ZE U NIET BEVALLEN; U MOET DE REDEN VOOR HET WEGSTREPEN AANGEVEN. De reden kan voor de hand liggen, zoals “eindpunt overschreden”, maar het kan ook zijn dat u alleen op basis van statistische tests een waarde kunt schrappen.
Molariteit van azijnzuur in azijn
Conditioneer de buret met gestandaardiseerd NaOH van de vorige week.
Conditioneer een pipet van 10 ml met de azijnoplossing.
Meet 10 mL azijn af in een erlenmeyer en voeg fenolftaleïne-indicator toe.
Titreer met de standaard NaOH uit het vorige lab.
Interactieve Poster Sessie
Als je groep klaar is met je werk, bereid je een whiteboard voor dat je kunt gebruiken om je ideeën te delen en te verantwoorden. Zie de bijgeleverde hand-out voor details over dit proces.
Rapport
Als jullie je onderzoek hebben afgerond, moeten jullie een onderzoeksrapport opstellen dat uit drie delen bestaat. Dit verslag kan meer dan twee pagina’s met gegevenstabellen beslaan. Dit verslag moet getypt zijn en eventuele diagrammen, figuren of tabellen moeten in het document worden opgenomen.
- Sectie 1: Welk concept en/of techniek heb je onderzocht, en hoe verhoudt zich dat tot de leidende vraag? Welke factoren bepalen hoe nauwkeurig en hoe precies de concentratie van azijnzuur in azijn kan worden bepaald? Beschrijf titratie en het gebruik ervan in combinatie met molaire stoichiometrie om de concentratie te bepalen.
- Sectie 2: Hoe ben je te werk gegaan, en waarom heb je je onderzoek op deze manier uitgevoerd? Meer specifiek, welke maatregelen heb je genomen om de nauwkeurigheid en precisie te waarborgen?
- Hoofdstuk 3: Het argument in dit onderzoek is niet zozeer voor je resultaat, maar voor de geldigheid en betrouwbaarheid van je gegevens. Dit verslag moet een uitgebreide gegevenstabel bevatten, vergelijkbaar met de tabel die je hebt gebruikt in de pre-lab oefening waarin je de molariteit van je base hebt gevonden. Rapporteer niet over het standaardisatieproces van de base, behalve dat je de NaOH molariteit met standaardafwijking rapporteert. Je moet motiveren waarom je een van de azijntitratieproeven hebt verworpen. Je moet één volledige berekening laten zien van de molariteit en het massapercentage van de azijn. In je eindantwoord voor de molariteit van de azijn moet je een standaardafwijking opnemen.
- In dit derde deel presenteer je niet alleen je gegevens, maar gebruik je de verkregen waarden ook als bewijs in je redenering. Uitspraken als, “zie de gegevenstabel voor de waarden” zijn niet aanvaardbaar!