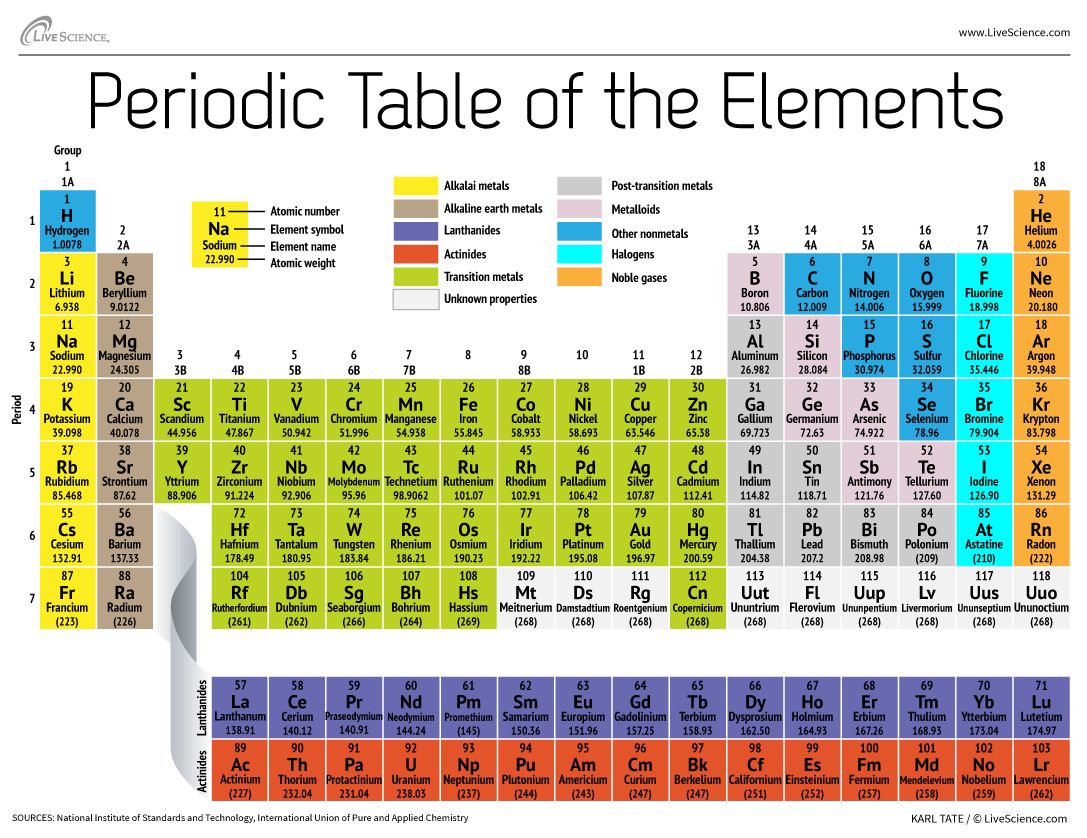
Het periodiek systeem der elementen rangschikt alle bekende chemische elementen in een informatieve reeks. De elementen zijn gerangschikt van links naar rechts en van boven naar beneden in volgorde van toenemend atoomnummer. De volgorde valt in het algemeen samen met de toenemende atoommassa.
De rijen worden periodes genoemd. Het periodegetal van een element geeft het hoogste energieniveau aan dat een elektron in dat element inneemt (in de niet-geactiveerde toestand), volgens het Los Alamos National Laboratory. Het aantal elektronen in een periode neemt toe naarmate men lager in het periodiek systeem komt; naarmate het energieniveau van het atoom toeneemt, neemt dus ook het aantal energiesubniveaus per energieniveau toe.
Elementen die in dezelfde kolom van het periodiek systeem zitten (een “groep” genoemd) hebben identieke valantie-elektronenconfiguraties en gedragen zich chemisch dus op dezelfde manier. Zo zijn bijvoorbeeld alle elementen van groep 18 inerte gassen.
“Vader” van het periodiek systeem
Dmitri Mendelejev, een Russische chemicus en uitvinder, wordt beschouwd als de “vader” van het periodiek systeem, volgens de Royal Society of Chemistry. In de jaren 1860 was Mendelejev een veelgevraagd docent aan een universiteit in Sint-Petersburg, Rusland. Aangezien er in die tijd geen moderne leerboeken voor organische chemie in het Russisch waren, besloot Mendelejev er een te schrijven en tegelijkertijd het probleem van de ongeordende elementen aan te pakken.
De elementen in een of andere volgorde zetten zou heel moeilijk blijken. Op dat moment was minder dan de helft van de elementen bekend, en van sommige daarvan waren verkeerde gegevens gegeven.
Mendelejev schreef uiteindelijk het definitieve scheikundetekstboek van zijn tijd, getiteld “Beginselen van de Scheikunde” (twee delen, 1868-1870), volgens Khan Academy. Terwijl hij eraan werkte, deed hij een belangrijke ontdekking die in grote mate zou bijdragen tot de ontwikkeling van het huidige periodiek systeem. Nadat hij de eigenschappen van de elementen op kaartjes had geschreven, begon hij ze te ordenen volgens toenemend atoomgewicht, volgens de Royal Society of Chemistry. Toen merkte hij dat bepaalde soorten elementen regelmatig opdoken. Na drie dagen intensief aan deze “puzzel” gewerkt te hebben, zei Mendelejev dat hij een droom had waarin alle elementen op hun plaats vielen zoals vereist. Toen hij wakker werd, schreef hij ze onmiddellijk op een stuk papier – slechts op één plaats leek een correctie nodig, zei hij later.
Mendelejev rangschikte de elementen zowel naar atoomgewicht als valentie. Niet alleen liet hij ruimte voor nog niet ontdekte elementen, maar hij voorspelde ook de eigenschappen van vijf van deze elementen en hun verbindingen. In 1869 presenteerde hij zijn bevindingen aan het Russisch Chemisch Genootschap. Zijn nieuwe periodiek systeem werd gepubliceerd in het Duitse scheikundig tijdschrift Zeitschrift fϋr Chemie (Tijdschrift voor Chemie).
Het lezen van de tabel
Het periodiek systeem bevat een enorme hoeveelheid belangrijke informatie:
Atoomnummer: Het aantal protonen in een atoom wordt het atoomnummer van dat element genoemd. Het aantal protonen bepaalt welk element het is en bepaalt ook het chemische gedrag van het element. Koolstofatomen hebben bijvoorbeeld zes protonen, waterstofatomen hebben er één en zuurstofatomen hebben er acht.
Atomisch symbool: Het atoomsymbool (of elementensymbool) is een gekozen afkorting om een element weer te geven (“C” voor koolstof, “H” voor waterstof en “O” voor zuurstof, etc.). Deze symbolen worden internationaal gebruikt en zijn soms onverwacht. Het symbool voor wolfraam is bijvoorbeeld “W” omdat een andere naam voor dat element wolfraam is. Ook is het atoomsymbool voor goud “Au” omdat het woord voor goud in het Latijn aurum is.
Atomair gewicht: Het standaard atoomgewicht van een element is de gemiddelde massa van het element in atomaire massa eenheden (amu). Individuele atomen hebben altijd een geheel aantal atomaire massa eenheden; de atomaire massa op het periodiek systeem wordt echter aangegeven als een decimaal getal omdat het een gemiddelde is van de verschillende isotopen van een element. Het gemiddelde aantal neutronen voor een element kan worden gevonden door het aantal protonen (atoomnummer) af te trekken van de atoommassa.
Atoomgewicht voor elementen 93-118: Voor natuurlijk voorkomende elementen wordt het atoomgewicht berekend door het gemiddelde te nemen van de gewichten van de natuurlijke abundanties van de isotopen van dat element. Voor in het labo gecreëerde trans-uraniumelementen – elementen met een atoomnummer hoger dan 92 – bestaat er echter geen “natuurlijke” abundantie. De conventie is om het atoomgewicht van de langstlevende isotoop in het periodiek systeem te vermelden. Deze atoomgewichten moeten als voorlopig worden beschouwd, omdat in de toekomst een nieuwe isotoop met een langere halveringstijd zou kunnen worden geproduceerd.
Binnen deze categorie vallen de superzware elementen, of die met atoomnummers boven 104. Hoe groter de atoomkern – die toeneemt met het aantal protonen binnenin – hoe onstabieler dat element in het algemeen is. Als zodanig zijn deze buitenproportionele elementen vluchtig, zij blijven slechts milliseconden bestaan voordat zij vervallen in lichtere elementen, volgens de Internationale Unie voor Zuivere en Toegepaste Chemie (IUPAC). Zo werden de superzware elementen 113, 115, 117 en 118 in december 2015 door de IUPAC geverifieerd, waarmee de zevende rij, of periode, op de tafel werd vervolledigd. Verschillende laboratoria hebben de superzware elementen geproduceerd. De atoomnummers, tijdelijke namen en officiële namen zijn:
- 113: ununtrium (Uut), nihonium (Nh)
- 115: ununpentium (Uup), moscovium (Mc)
- 117: ununseptium (Uus), tennessine (Ts)
- 118: ununoctium (Uuo), oganesson (Og)
Aanvullende rapportage door Traci Pedersen, medewerker Live Science
Recent nieuws