1. Morfologia
2. Funções
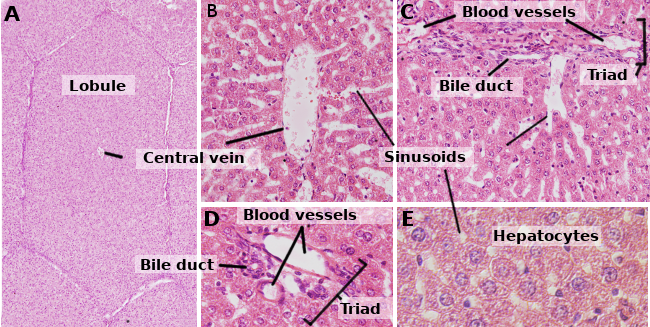
Hepatócitos são as células do fígado, representando cerca de 80 % deste órgão. Estão organizados em folhas de cerca de uma célula em espessura. As folhas estão ligadas entre si formando uma estrutura tipo esponjosa (Figuras 1 e 2). Os hepatócitos são células de vida bastante longa, sendo renovadas cerca de 5 em 5 meses. No entanto, podem mudar sob processos regenerativos onde os hepatócitos mostram uma elevada capacidade de proliferação e regeneração de tecido hepático danificado.

Morfologia
Hepatócitos são células poledrais, ou seja, têm várias faces. Normalmente apresentam 6 caras, mas o número pode variar. As faces estão em contacto com qualquer outro hepatócito ou com um sinusoidal (Figura 3). Os hepatócitos são células grandes, de cerca de 20 a 30 µm de diâmetro. Mostram um núcleo redondo centrado no citoplasma. No entanto, no fígado de humanos adultos, até 25% dos hepatócitos podem ser binucleados (Figura 2). A maioria dos núcleos são tetraplóides, pelo que contêm o dobro de ADN do que uma célula normal. O tamanho dos núcleos é variável, embora sejam maiores em células tetraplóides. Os núcleos mostram heterocromatina dispersa e um ou mais núcleos. Não é comum observar hepatócitos mitóticos (1 a cada 10000 ou 20000 hepatócitos) em condições normais. No entanto, os hepatócitos mitóticos aumentam enormemente sob lesões hepáticas e processos de regeneração. As características do citoplasma variam de acordo com o estado fisiológico da célula, influenciado principalmente por depósitos de gordura e glicogénio. Existem muitas pequenas mitocôndrias, 800 a 100 por hepatócito. Estima-se que um hepatócito pode conter cerca de 50 aparelhos Golgi que são normalmente organizados em pilhas de 3 a 5 cisternas mostrando regiões laterais espessadas contendo corpos escuros. As pilhas de cisternas estão de alguma forma dispersas no citoplasma, embora sejam frequentemente observadas perto de bilhares de canalículos (Figuras 3 e 4). Os hepatócitos contêm muitos peroxisomas (200 a 300), mais do que outras células regulares. Perto do canalículo de bilhar, são também encontrados muitos lisossomas.


Depósitos abundantes de glicogénio e lípidos encontram-se no citoplasma hepatocitário (o aspecto granular dos hepatócitos após a coloração de hematoxilina e eosina deve-se aos orifícios deixados pela extracção de lípidos do citoplasma durante o processamento do tecido). No citoplasma, há também corpos residuais contendo lipofuscina. O retículo endoplasmático liso é bastante abundante, embora o tamanho da organela varie com a actividade metabólica do hepatócito. Está concentrado em redor de depósitos de glicogénio. Nos lóbulos hepáticos, existem diferenças morfológicas quando se comparam os hepatócitos periféricos e centrais, na sua maioria influenciados pelas características do sangue. Por exemplo, após a digestão, os hepatócitos periféricos são os primeiros a armazenar o glicogénio, mas os últimos a movimentar este glicogénio quando o resto do corpo o exige. No entanto, o armazenamento de gordura acontece primeiro nos hepatócitos localizados centralmente, que normalmente têm um retículo endoplasmático mais suave. Por outro lado, o retículo endoplásmico rugoso mostra 50% mais superfície nos hepatócitos periféricos e de localização média do que os da parte interna do lóbulo hepático.
Não semelhantes a outras células epiteliais, os hepatócitos não estão ligados a uma membrana basal. As suas membranas basolaterais são rodeadas por uma matriz extracelular de baixa densidade, sintetizada pelos próprios hepatócitos. Facilita a difusão e troca de moléculas com os sinusóides através do espaço de Disse, ou espaços perisinousoidais, que é o espaço entre o endotélio fenestrado e os hepatócitos. Esta matriz extracelular carece de laminina, pelo menos quando o hepatócito é diferenciado. No entanto, o colagénio tipo IV e a fibronectina parecem necessários para uma diferenciação hepatocitária adequada. Os hepatócitos estão ligados entre si por junções de fendas, junções aderentes, desmosomas e junções apertadas.
Os hepatócitos são células polarizadas, ou seja, existem diferenças entre as regiões que enfrentam o canalículo biliar e as regiões próximas dos sinusóides. A polaridade é essencial para o funcionamento correcto do hepatócito, e está desorganizada em muitas patologias hepáticas. A região apical está em contacto com o canaliculi biliar. Tal como no domínio apical das células epiteliais, existem junções estreitas, que selam e mantêm a integridade dos canalículos biliares. A membrana apical dobra-se em microfiliais que aumentam enormemente a superfície da membrana. A membrana apical é cerca de 13% da membrana hepática total, e é capaz de conter uma grande quantidade de moléculas. A remoção de junções apertadas leva à desorganização da polaridade celular. A polaridade dos hepatócitos e dos canalículos biliares é estabelecida durante o período de desenvolvimento embrionário.
A polaridade funcional depende de uma distribuição desigual dos transportadores e outras moléculas de membrana entre os domínios apical e baso-lateral da membrana plasmática. Os transportadores ABC (cassettes de ligação ATP) estão entre os mais importantes transportadores apicais em hepatócitos. O aparelho de Golgi, endossomas e citoesqueleto (microtubos e filamentos de actina) são responsáveis pela distribuição diferencial das moléculas entre os dois domínios de membrana. Existem duas vias de distribuição de proteínas para o domínio apical (Figura 5): do aparelho de Golgi, as proteínas (por exemplo, os transportadores ABC) são libertadas em vesículas em direcção à membrana de plasma apical ou em direcção aos endossomas de reciclagem, que funcionam como intermediários. Outras proteínas seguem um caminho de transcitose, viajando primeiro para as membranas basolaterais e depois são encerradas em vesículas de endocitose em direcção aos endossomas, onde são novamente embaladas em vesículas e enviadas para a membrana apical. Mais raro é um caminho que envolve a exocitose de lisossomas, seguido por transportadores de tanoeiro.

Funções
A principal função dos hepatócitos é metabolizar as substâncias provenientes da digestão. O fígado é irrigado pela veia portal que recolhe as moléculas resultantes da digestão no intestino. Os hepatócitos estão também fortemente envolvidos na desintoxicação de moléculas potencialmente nocivas. Por outro lado, os hepatócitos sintetizam a bílis, que é finalmente libertada para o intestino e ajuda na digestão. Para ambas as funções, metabolizando moléculas da digestão e libertando bílis, os hepatócitos são colocados num local privilegiado: em contacto com sinusoides, que trazem moléculas digeridas do intestino, e formam o canal biliar que drena a bílis dos lóbulos do fígado.
Níveis de glicose. Os hepatócitos apanham moléculas de glucose provenientes da digestão e armazenam-nas como glicogénio, que é mobilizado quando o corpo necessita de energia. O glicogénio é normalmente encontrado perto do retículo endoplasmático, uma vez que a enzima glucose-6-fosfátase está localizada nesta organela. A glucose-6-fosfátase catalisa o glucose-6-fosfato, a forma molecular da glucose após o catabolismo do glicogénio, e produz glicose livre, que pode sair do hepatócito e atingir a corrente sanguínea.
Síntese de moléculas. Os sais biliares, que ajudam na digestão da gordura, são uma das substâncias sintetizadas pelos hepatócitos. No retículo endoplasmático liso, existem muitas enzimas envolvidas na síntese de colesterol e outros lípidos. Além disso, os hepatócitos produzem as lipoproteínas necessárias para o transporte dos lípidos na corrente sanguínea. O fibrinogénio para a coagulação do sangue e as albuminas plasmáticas são também sintetizadas por hepatócitos. No fígado, a ureia é produzida como um subproduto da degradação proteica. A produção e acumulação de elevada quantidade de ureia no organismo pode ser prejudicial. Os hepatócitos armazenam as vitaminas A e B, e a heparina.
Metabolismo lipídico. A beta-oxidação, envolvida no catabolismo lipídico, funciona nos abundantes peroxisomas dos hepatócitos.
Desintoxicação. Os hepatócitos recolhem substâncias nutritivas provenientes da digestão, mas são também os primeiros a receber substâncias potencialmente tóxicas. O etanol de bebidas alcoólicas degrada-se principalmente no fígado, na verdade nos muitos peroxisomas dos hepatócitos. Metade do álcool ingerido é transformado em acetaldeído nestas organelas. Existem enzimas no retículo endoplasmático liso envolvidas na degradação ou inactivação de toxinas e drogas. Durante os períodos de grande procura de remoção de substâncias tóxicas, como durante tratamentos medicamentosos ou consumo contínuo de álcool, o retículo endoplasmático pode tornar-se a organela mais volumosa do hepatócito. As drogas são geralmente inactivadas por conjugação com outras moléculas. Por vezes, a glucosiltransferase conjuga as moléculas com barbitúricos.
Armazenar e regular o ferro. Os hepatócitos podem funcionar para armazenar ferro, que é concentrado em depósitos citoplasmáticos ligados à ferritina. Os hepatócitos podem capturar ferro de várias formas: ligado à transferrina, como parte de grupos heme e de grupos não heme. A transferrina de ferro entra na célula através da endocitose mediada por receptores TRF1. Quando as vesículas endocíticas se fundem com endossomas, a transferrina liberta Fe3+, que é transformada em F2+ e extrudida para o citosol por DMT1 (transportador de metal divalente 1) transportador. As moléculas de ferro-hemónio são também endocitadas e translocadas para o citosol através da membrana endossómica pelo transportador de HRG1. Contudo, a maior parte do ferro entra do espaço extracelular através do transportador ZIP14 colocado na membrana de plasma hepatócito de frente para os sinusóides. Uma vez no citosol, o ferro é ligado à ferritina e armazenado no citoplasma porque o ferro livre é tóxico. A libertação do ferro do enterócito é mediada pelo transportador de ferroportina encontrado na membrana plasmática perto dos sinusóides.
Após a medula óssea, o fígado é o segundo maior centro de produção dos grupos heme. O grupo heme é um grupo prostético (não péptido) presente em várias proteínas para o transporte de oxigénio, naquelas enzimas como as catalases e peroxidases que protegem contra as substâncias oxidantes. Faz também parte dos citocromos mitocondriais e peroxissomais. A maior quantidade de grupos heme é encontrada na hemoglobina, que é sintetizada na medula óssea. No fígado, a síntese dos grupos heme depende da quantidade de citocromos microssómicos p450 necessários à célula, de modo que a maioria destes grupos heme fazem parte dos citocromos p450.
Os hepatócitos libertam a hormona hepcidina, que regula a concentração sistémica de ferro no corpo. Esta hormona controla a quantidade de ferro no plasma favorecendo a internalização e degradação da ferroportina, transportador de ferro encontrado em enterócitos, macrófagos e hapatócitos. A remoção da ferroportina inibe a libertação de ferro a partir destas células. A síntese da Hepcidina é regulada pela concentração de ferro transferrina no plasma, por depósitos de ferro nos hepatócitos e por inflamação. A actividade eritropoyetic inibe a libertação de hepcidina.
Bibliografia
Gissen P, Arias IM. 2015. Polaridade estrutural e funcional dos hepatócitos e doença hepática. Diário de hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Células estaminais intestinais adultas: factores críticos da homeostase epitelial e da regeneração. Revisão da natureza na biologia das células moleculares. 15:19-33.
Weiss L, Greep RO. 1982. Histologia. 4ªedición. Editorial el Ateneo. Barcelona.