
Há muita química e física por detrás da beleza e luz de uma chama de vela. De facto, os cientistas têm sido fascinados pelas velas há centenas de anos.
Em 1860, Michael Faraday deu a sua agora famosa série de palestras sobre a História Química de uma Vela, demonstrando dezenas de princípios científicos através das suas observações cuidadosas de uma vela acesa.
No final dos anos 90, a NASA levou a investigação de velas a novas alturas, conduzindo experiências de vaivém espacial para aprender sobre o comportamento das chamas das velas em microgravidade.
Cientistas em universidades e laboratórios de investigação em todo o mundo continuam a conduzir experiências com velas para aprender mais sobre as chamas das velas, emissões e combustão.
E, claro, milhares de estudantes todos os anos investigam os princípios de calor, luz e combustão através de projectos de ciência escolar envolvendo velas.
Click Here for Science Project Ideas & Tips
How Candles Burn
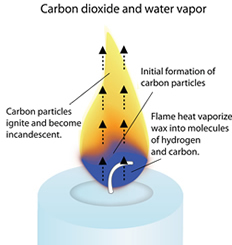
Todas as ceras são essencialmente hidrocarbonetos, o que significa que são largamente compostos por átomos de hidrogénio (H) e carbono (C).
Quando se acende uma vela, o calor da chama derrete a cera perto do pavio. Esta cera líquida é então elaborada o pavio por acção capilar.
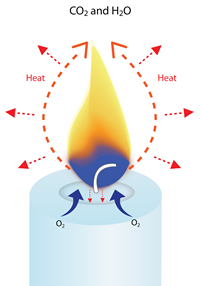
O calor da chama vaporiza a cera líquida (transforma-a num gás quente), e começa a decompor os hidrocarbonetos em moléculas de hidrogénio e carbono. Estas moléculas vaporizadas são arrastadas para a chama, onde reagem com o oxigénio do ar para criar calor, luz, vapor de água (H2O) e dióxido de carbono (CO2).
Apenas um quarto da energia criada pela combustão de uma vela é libertada à medida que o calor irradia da chama em todas as direcções.
Suficientemente calor é criado para irradiar de volta e derreter mais cera para manter o processo de combustão até que o combustível seja consumido ou o calor eliminado.
P>São necessários alguns minutos quando se acende pela primeira vez uma vela para que este processo de combustão se estabilize. A chama pode cintilar ou fumar um pouco no início, mas uma vez o processo estabilizado, a chama arderá limpa e firmemente em forma de lágrima silenciosa, libertando dióxido de carbono e vapor de água.
Uma chama de vela silenciosa é uma máquina de combustão muito eficiente. Mas se a chama ficar com muito pouco ou muito ar ou combustível, pode cintilar ou queimar e as partículas de carbono não queimadas (fuligem) escaparão da chama antes de poderem entrar em combustão total.
A cintilação de fumo que por vezes se vê quando a cintilação de uma vela é de facto causada por partículas de fuligem não queimadas que escaparam da chama devido à combustão incompleta.
Click Here for Candle Research Studies
The Colors of a Candle Flame
Se olhar atentamente para uma chama de vela, verá uma área azul na base da chama. Acima disso há uma pequena secção castanha alaranjada escura, e acima disso está a grande região amarela que associamos às chamas das velas.
A zona azul rica em oxigénio é onde as moléculas de hidrocarboneto se evaporam e começam a desfazer-se em átomos de hidrogénio e carbono. O hidrogénio é o primeiro a separar-se aqui e reage com o oxigénio para formar vapor de água. Parte do carbono queima aqui para formar dióxido de carbono.
A região escura ou laranja/castanha tem relativamente pouco oxigénio. É aqui que as várias formas de carbono continuam a decompor-se e pequenas partículas de carbono endurecido começam a formar-se.
À medida que sobem, juntamente com o vapor de água e o dióxido de carbono criado na zona azul, são aquecidas a aproximadamente 1000 graus centígrados.
No fundo da zona amarela, a formação das partículas de carbono (fuligem) aumenta. À medida que se elevam, continuam a aquecer até se incandescerem e emitem todo o espectro de luz visível. Como a parte amarela do espectro é a mais dominante quando o carbono se inflama, o olho humano percebe a chama como amarelada. Quando as partículas de fuligem oxidam perto do topo da região amarela da chama, a temperatura é de aproximadamente 1200o C.
A quarta zona da vela (por vezes chamada de véu) é a borda azul exterior ténue que se estende da zona azul na base da chama e para cima dos lados do cone da chama. É azul porque se encontra directamente com o oxigénio do ar, e é a parte mais quente da chama, atingindo normalmente 1400o C (2552o F).
Porque uma chama de vela aponta sempre para cima
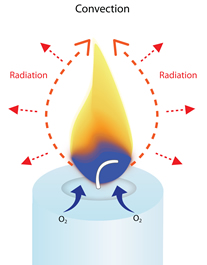
Quando uma vela se queima, a chama aquece o ar próximo e começa a subir. Quando este ar quente se move para cima, o ar mais frio e o oxigénio entram no fundo da chama para o substituir.
Quando esse ar mais frio é aquecido, ele também sobe e é substituído por ar mais frio na base da chama.
Isto cria um ciclo contínuo de ar em movimento ascendente à volta da chama (uma corrente de convecção), que dá à chama a sua forma alongada ou de lágrima.
Porque “para cima” e “para baixo” são uma função da gravidade da Terra, os cientistas perguntaram-se como seria uma chama de vela no espaço exterior, onde a atracção da gravidade é mínima e não há realmente um para cima ou para baixo.
No final dos anos 90, os cientistas da NASA fizeram várias experiências de vaivém espacial para ver como as chamas das velas se comportavam em microgravidade. Como se pode ver nas fotos da NASA abaixo, uma chama de vela na microgravidade é esférica em vez da sua forma alongada na Terra. Sem gravidade, não há direcção “para cima” para que o ar quente se levante e crie uma corrente de convecção.

Uma chama de vela em gravidade normal

p>Uma chama de vela em microgravura
Leitura interessante
A história química das velas
(série de palestras de Michael Faraday de 1860 em Londres)
wwww.bartleby.com
Candles in Microgravity
(NASA’s space program research on candles)
www.microgravity.gov
p>Candlestick Rocket Ship
(NASA’s experiments using parafin wax as rocket fuel.)
www.science.nasa.govp>The Physics and Chemistry Underlying the Infinite Charm of a Candle Flame
(By Jearl Walker. Originalmente impresso em The Amateur Scientist Column, Scientific American, Abril de 1978.)
www.bashaar.org.il