Questão orientadora
Que factores determinam a exactidão e a precisão da concentração de ácido acético no vinagre?
Introdução
Muitos laboratórios analisam os produtos de consumo para determinar a exactidão na rotulagem do produto. A técnica muito comum e simples de titulação é demonstrada nesta experiência. Uma titulação é um procedimento analítico em que uma reacção é executada sob condições cuidadosamente controladas. O volume estequiométrico de um reagente de concentração conhecida, o titulante, que é necessário para reagir com outro reagente de concentração desconhecida, o analito, é medido. A concentração da substância a analisar é determinada a partir da concentração e volume do titulante e da estequiometria da reacção entre eles. A configuração experimental é mostrada na Figura 1. Uma bureta, que contém o titulante, é calibrada para que o volume de solução que fornece possa ser determinado com elevada precisão e precisão. O titrante é adicionado ao analito até o volume estequiométrico do titrante ter sido adicionado. A isto chama-se o ponto de equivalência, no qual é lido o volume de titante entregue pela bureta. Normalmente, as leituras de volume são estimadas para o volume mais próximo de 0,01 mL. A entrega do titrante é ajustada com a torneira na bureta. Com a prática, pode-se dispensar fracções de uma gota de titulante e controlar o procedimento suficientemente bem que as titulações replicadas concordem dentro de 0,10 mL. Para este primeiro laboratório, será necessário que as suas titulações concordem dentro de 0,50 mL.
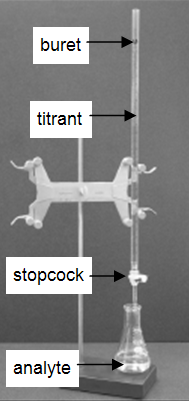
Figure 1: Configuração da titulação
Muitas vezes, o ponto de equivalência é determinado visualmente com um indicador. O indicador, que é uma substância que muda de cor perto do ponto de equivalência, é adicionado à solução de analito. Uma vez que a mudança de cor está próxima mas não exactamente no ponto de equivalência, o ponto em que a mudança de cor ocorre chama-se o ponto final. Os indicadores são escolhidos para que o ponto final esteja muito próximo do ponto de equivalência. É importante manter uma titulação bem misturada, para que o titulante e a substância a analisar possam contactar um com o outro e reagir rapidamente. Pode utilizar-se quer a agitação manual do frasco, quer a agitação mecânica. Nesta experiência será utilizada a agitação manual. O tipo de titulação mais comum é a titulação à base de ácido. Nesta experiência, irá determinar a concentração de ácido acético, HC2H3O2 em vinagre comercial. Nesta titulação, NaOH aquoso é o titulante, e o vinagre é o analito. Assumimos que a base forte e o ácido fraco reagem completamente de acordo com a equação líquida:
A equação equilibrada mostra 1:1 estequiometria, por isso podemos escrever:
ou mais genericamente:
As bolhas de base podem ser calculadas a partir de molaridade vezes volume
Como lembrete nas unidades de concentração, a molaridade é definida como o número de moles de soluto num litro de solução (M = mol/L). Isto é numericamente igual ao número de milimoles de soluto num mililitro de solução (M = mmol/mL). É frequentemente conveniente utilizar esta segunda definição de molaridade em titulações e outros trabalhos em que estão envolvidas pequenas quantidades. Há 1000 mmol em 1 mol e 1000 mL em 1 litro. Por exemplo, 10,2 mL de solução de NaOH 0,100 M contém 1,02 mmol de NaOH.
0.100 mmol de NaOH
>br>>p>1 solução de NaOHbr>= 1,02 mmol de NaOH
A molaridade do ácido pode ser calculada a partir de moles divididos por volume
Nesta experiência, um volume de vinagre cuidadosamente medido
é colocado num frasco e a massa determinada. A amostra de vinagre é então titulada com uma solução de NaOH de concentração conhecida
e é determinado o volume de solução de NaOH necessário para atingir o ponto final
.
e
são todos conhecidos, pelo que a concentração do ácido
pode ser determinada como descrito acima. Além disso, a massa de ácido acético na amostra pode ser determinada a partir do número de moles presentes e a massa molar de ácido acético
Finalmente, a massa percentual de ácido acético no vinagre pode ser determinada a partir da massa do ácido acético na amostra e da massa da solução de vinagre que foi titulada.
p>massa de ácido acético na amostrabr>>p>massa de solução de vinagre tituladobr>× 100
Na titulação do ácido acético com NaOH aquoso, a fenolftaleína é utilizada como indicador. A fenolftaleína é quase incolor em solução ácida mas fica rosa a um pH de cerca de 8, o que indica que a base neutralizou todo o ácido. À medida que se titula o vinagre, observa-se que a cor rosa é mais persistente à medida que se adiciona mais base. Isto é um sinal para abrandar a adição de base, e controlá-la cuidadosamente. O ponto final foi alcançado quando uma cor rosa ténue persiste durante pelo menos 30 segundos. É fácil exagerar o ponto final. Se isto acontecer, terá uma solução púrpura-rosa escuro, e terá de repetir a titulação, por isso tenha cuidado. Repare no volume que utilizou, pare a menos deste volume nas titulações subsequentes, e adicione o último mililitro ou assim gota a gota. O seu instrutor mostrar-lhe-á como controlar a torneira da bureta para facilitar isto. Note que as medições de volume nas titulações são normalmente reportadas a quatro figuras significativas, pelo que as concentrações são normalmente reportadas também a quatro figuras significativas. Observe isto no seu trabalho; ao calcular as massas molares, certifique-se de ter quatro figuras significativas.
Goals
Ao concluir esta investigação irá:
-
1
padronizar uma solução NaOH(aq).
-
2
Titular uma amostra de vinagre com a solução de NaOH(aq) padronizada.
-
3
Medir a densidade de uma amostra de vinagre.
-
4
Calcular a molaridade e a percentagem de massa de ácido acético na amostra de vinagre.
Materiais disponíveis para uso
Pipetas li>Pipetas 125 mL
Precauções de segurança
NaOH é corrosivo. Pode atacar a pele e causar danos permanentes nos olhos. Se a solução de NaOH salpicar para os seus olhos, utilize imediatamente a estação de lavagem ocular. Mantenha os olhos abertos e lave-os com água. Se ocorrer contacto com a pele ou vestuário, lavar a área afectada com água. Peça ao seu parceiro de laboratório que notifique o seu instrutor sobre o derrame.
Arrancar
A sua primeira tarefa é normalizar a solução de NaOH usando KHP sólido (KC8H5O4, 204,22 g/mol). Isto significa que precisa de determinar a sua molaridade a pelo menos três figuras significativas. Precisará de pelo menos três titulações que estejam de acordo dentro de 1%, tal como descrito no procedimento. Terá duas outras tarefas a realizar no laboratório. Deve determinar a densidade da solução de vinagre e a molaridade do ácido acético em vinagre. A percentagem de massa do ácido acético pode ser calculada a partir dos seus dados. Para realizar as suas tarefas, terá de fazer medições de volume e massa muito precisas. Os buretes e pipetas são úteis na medição precisa de volumes. A bureta e a pipeta são descritas na introdução e nos vídeos. Antes de começar, certifique-se de compreender o seu uso correcto.
Procedimento
Por favor imprima a folha de trabalho para este laboratório. Irá precisar desta folha para registar os seus dados.

Preparação de Buret
Verifique a bureta lavando os lados com uma garrafa de água destilada para verificar se as “folhas” de água estão dentro da bureta. Se forem observadas gotículas de água, a bureta deve ser lavada antes da sua utilização. Ter cuidado para não riscar a superfície interna se achar necessário utilizar um pincel de bureta para a limpar. Lavar bem a bureta com água da torneira, incluindo a torneira e as anilhas. Em seguida, enxaguar as paredes da bureta com água desionizada/destilada.
Finalmente enxaguar a bureta pelo menos TWICE com pequenas porções da sua solução de NaOH para assegurar que toda a água é removida. Passe a solução pela ponta.
Encha a bureta com solução de NaOH utilizando um funil.
Para RETIRAR AS BORRAS DE AR TRAPFEITO na ponta da bureta após o enchimento, ABRIR E FECHAR RÁPIDAMENTE OS TEMPOS DE STOPCOCK SEVERAL. Nota: Se a torneira se alinhar correctamente com a ponta da bureta, as bolhas de ar presas não são tão prevalentes. Verificar com o instrutor se a bolha persiste.
Padrão com KHP
Usar ~1 grama de KHP. REGISTAR IMEDIATAMENTE A MASSA NO GRÁFICO DE DADOS.
Utilizar o frasco de lavagem com água destilada para garantir que todas as amostras foram transferidas para o frasco.
Adicionar cerca de 50 mL de água destilada e duas ou três gotas de indicador. A fenolftaleína indicadora será utilizada nesta experiência de titulação. Não usar demasiado indicador ou estará também a titular essa molécula. Seja consistente na utilização do mesmo número de gotas em todas as amostras.
Técnica de titulação
Coloque uma folha de papel branco debaixo do frasco receptor para observar mais facilmente o ponto final.
Utilize um cartão branco dividido de cima/preto de baixo para ajudar na leitura do menisco. A colocação do cartão atrás da bureta e a linha preta logo abaixo do menisco escurece o menisco para facilitar a leitura. GRAVE O VOLUME INICIAL DA SOLUÇÃO DE NaOH PARA O MILITADOR DE CAMPO A PRÓXIMO (±0,01 mL) NA TABELA DE DADOS DO SEU NOTABOOK.
O titulante (solução de NaOH em bureta) pode ser adicionado bastante rapidamente no início, mas à medida que o ponto final se aproxima, a taxa de adição deve ser abrandada. Se for destro, é mais rápido adicionar o titrante com a mão esquerda, enquanto se roda com a direita (vice versa para esquerdinos). À medida que o ponto final é aproximado, a cor rosa persistirá mais e mais tempo. Perto do ponto final, lavar as paredes do frasco com água destilada para garantir que toda a base de NaOH adicionada tenha reagido. Quando muito próximo do ponto final, suspender uma meia gota de base na ponta da bureta e enxaguar a gota no frasco receptor com o frasco de lavagem com água destilada. Outro método utilizado para adicionar uma fracção de gota é rodar a torneira 180 graus muito rapidamente; no entanto, é possível adicionar inadvertidamente demasiada base se se fizer esta técnica de forma incorrecta.
O ponto final ocorre quando a fenolftaleína muda da cor clara para a cor rosa mais ténue que se pode ver e persiste por um mínimo de 30 segundos. REGISTA O VOLUME FINAL DA SOLUÇÃO DE NaOH PARA O MILITRO DE FENOLFETALINA A NECESSIDADE (±0,01 mL) NA TABELA DE DADOS. Em seguida, determinar a quantidade de solução de NaOH utilizada na titulação.
O seu grupo deve completar um MÍNIMO DE QUATRO TREINOS e três ensaios devem concordar COM ±1%. Pode realmente fazer mais, dependendo da sua técnica. NÃO PODE SIMPLESMENTE “RISCAR” OS DADOS PORQUE NÃO GOSTA; DEVE INDICAR O MOTIVO DO DESCARTE. A razão pode ser óbvia, tal como “overran endpoint” ou pode apenas ser capaz de se desfazer de valores baseados em testes estatísticos.
Molaridade do Ácido Acético em Vinagre
Condicionar a bureta com NaOH padronizado da semana anterior.
Condicionar uma pipeta de 10 mL com a solução de vinagre.
Medir 10 mL de vinagre num frasco de Erlenmeyer e adicionar o indicador de fenolftaleína.
Titular com o NaOH padrão do laboratório anterior.
Sessão de Poster Interactivo
Uma vez que o seu grupo tenha concluído o seu trabalho, prepare um quadro branco que pode utilizar para partilhar e justificar as suas ideias. Ver o folheto fornecido para detalhes sobre este processo.
Relatório
Uma vez completada a sua investigação, terá de preparar um relatório de investigação que consiste em três secções. Este relatório pode requerer mais de duas páginas com tabelas de dados. Este relatório deve ser digitado e quaisquer diagramas, figuras, ou tabelas devem ser incorporados no documento.
- Secção 1: Que conceito e/ou técnica estava a investigar, e como é que se relaciona com a pergunta orientadora? Que factores determinam a precisão e a precisão da concentração de ácido acético em vinagre? Descreva a titulação e a sua utilização em conjunto com a estequiometria molar para determinar a concentração.Li>Secção 2: Como realizou o seu trabalho, e porque conduziu a sua investigação desta forma? Especificamente, que medidas tomou para assegurar a precisão e precisão?li>Secção 3: O argumento nesta investigação não é tanto pelo seu resultado, mas pela validade e fiabilidade dos seus dados. Este relatório deve incluir uma tabela de dados abrangente semelhante à que utilizou no exercício de pré-laboratório, onde encontrou a molaridade da sua base. Não informe sobre o processo de padronização da base, a não ser para informar a molaridade NaOH com desvio padrão. Tem de justificar a eliminação de qualquer dos ensaios de titulação do vinagre. Deve apresentar um cálculo completo da molaridade e da % de massa do vinagre. A sua resposta final para a molaridade do vinagre deve incluir um desvio padrão.
- Esta terceira secção é onde não só apresenta os seus dados, mas utiliza os valores que obtém como prova no seu raciocínio. Declarações como, “ver tabela de dados para valores” não são aceitáveis!