P>P>Primeiro descoberto em 1961 e que levou até aos anos 70, a amiodarona foi utilizada pelas suas propriedades antiarrítmicas, embora não oficialmente antes do ano 1985, quando os Estados Unidos finalmente aprovaram a sua utilização. A Food and Drug Administration (FDA) tinha sido relutante em aprovar o fármaco devido a relatórios iniciais mostrando um aumento da incidência de efeitos pulmonares adversos. As empresas farmacêuticas europeias começaram a discutir com a instituição em meados dos anos 80 e ameaçaram suspender o seu fornecimento (gratuito) do medicamento aos médicos americanos, caso a FDA não concedesse a aprovação oficial. A autorização foi finalmente emitida em Dezembro de 1985, tornando-o um dos poucos medicamentos aprovados pela FDA sem ensaios clínicos aleatórios prévios.
I – Mecanismo de acção e efeitos farmacologistas
Os dois átomos de iodo contidos na molécula de amiodarona, um derivado benzofurano, são essenciais para as suas propriedades antiarrítmicas. Usando a classificação Vaughan-Williams de medicamentos antiarrítmicos, a amiodarona prolonga o potencial de acção da Fase 3 das células cardíacas e tem também todas as características electrofisiológicas da Classe 4.
Absorção é extremamente lenta, e a biodisponibilidade é também baixa e variável. A latência entre a administração e o efeito, contudo, pode ser reduzida utilizando uma elevada carga de dose oral ou intravenosa.
Por outro lado, a droga liga-se completamente às proteínas plasmáticas e tem um grande volume de distribuição. É depois metabolizado no fígado. A depuração também é baixa com uma semi-vida de eliminação estimada de 30-180 dias devido ao seu metabolito, a desetilamiodarona, que faz com que a droga se acumule nos tecidos periféricos que actuam como reservatórios devido à sua afinidade com os fosfolípidos intralisosomais. Estes corpos de inclusão foram encontrados nos pulmões, fígado, coração, pele, epitélio corneal e nervos periféricos, o que explica os seus efeitos tóxicos em muitos órgãos e a relação proporcional entre toxicidade, duração da utilização e dose cumulativa.
Uma dose padrão de manutenção diária de 200 mg de amiodarona liberta 75 mg de iodo orgânico. É importante salientar que a necessidade diária normal de iodo é de 0,2 a 0,8 mg – mais de 100 vezes inferior ao que é fornecido com amiodarona.
Amiodarona de baixa dose (100-300 mg por dia) é eficaz para uma grande variedade de arritmias ventriculares e supraventriculares, inclusive como parte de uma estratégia de controlo do ritmo para pacientes com fibrilhação atrial, especialmente quando a doença estrutural do coração está presente. Onde outros medicamentos não conseguiram controlar as arritmias, serão necessárias doses elevadas de amiodarona e produzir um aumento na incidência de efeitos secundários adversos graves.
II – Impacto da terapia com amiodarona na sobrevivência no contexto clínico
Efeitos secundários graves têm sido descritos ao longo do tempo, especialmente em casos de utilização crónica. Estima-se que a prevalência de efeitos adversos relacionados com o tratamento com amiodarona é de 15% no primeiro ano e de 50% em casos de administração prolongada. Além disso, 20% dos doentes necessitam de terapia interrompida devido a efeitos tais como danos hepáticos, problemas com a função tiroideia e guincho pulmonar crónico, que foram descritos em até 1% por ano de tratamento, com danos cumulativos entre 5% e 10%. Os danos pulmonares são os mais conhecidos: são produzidos após longa exposição à amiodarona (2,3), mas também houve relatos de toxicidade aguda.
Aqui estão os efeitos colaterais mais frequentes da droga:
a) Toxicidade pulmonar
Amiodarona (APT) é um dos efeitos secundários mais graves da utilização. A incidência é de aproximadamente 5% quando são utilizadas doses de 400 mg ou mais diariamente.
Interessantemente, a investigação de acompanhamento da fibrilação atrial do estudo de gestão do ritmo (AFFIRM) encontrou um aumento da incidência de toxicidade pulmonar em doentes com doença pulmonar pré-existente. No entanto, a mortalidade por causas pulmonares e a mortalidade global não foram mais elevadas entre estes pacientes, quando comparados com aqueles sem doença pulmonar pré-existente.
O mecanismo de acção desta patologia pode ser directo através da libertação de radicais livres, ou indirecto da hipersensibilidade do paciente. Os factores de risco associados a este efeito adverso não foram bem identificados, mas podem estar relacionados com doses cumulativas, doses diárias superiores a 400 mg, idade avançada e doença pulmonar subjacente.
Amiodarona toxicidade pulmonar pode apresentar-se de várias formas: doença intersticial pneumonia, angústia respiratória ou massas pulmonares solitárias. Os cenários clínicos são variáveis, sendo os sintomas mais comuns a dispneia e a tosse seca, mas os sintomas podem também incluir febre, perda de peso, hemoptise e dores no peito agravadas por movimentos respiratórios. As radiografias do tórax mostrarão alterações irregulares ou irregulares do infiltrado intersticial bilateral (Figuras 1 e 2). Os testes de função respiratória mostram um padrão restritivo com capacidade pulmonar total diminuída e difusa. O mecanismo da toxicidade pulmonar não foi estabelecido, mas também parece estar relacionado com a dose.
O diagnóstico de TPA é complicado pelos seus sintomas não específicos, resultados clínicos e resultados de imagiologia e testes laboratoriais, pelo que é considerado um diagnóstico de exclusão. O diagnóstico diferencial deve ser conduzido com insuficiência cardíaca, pneumonia, embolia pulmonar, e doença neoplásica. O prognóstico é favorável, com uma baixa taxa de mortalidade, excepto para os doentes que desenvolvem problemas respiratórios, cuja mortalidade se aproxima dos 50%. (3)
O tratamento é baseado na descontinuação de medicamentos e administração de corticosteróides, que deve ser continuado durante vários meses, apesar dos casos de melhoria inicial do estado do doente, uma vez que a longa meia-vida da amiodarona pode resultar numa nova exacerbação dos sintomas. A prevenção e detecção precoce desta potencial complicação requer uma radiografia do tórax obtida na linha de base e, posteriormente, anualmente.
b) Tiróide
Provas clínicas de hipotiroidismo ocorrem em até 20% dos doentes que tomam amiodarona. A amiodarona impede a conversão periférica de T4 para T3 e altera os testes de função tiroideia. As grandes quantidades de iodo contidas na amiodarona podem explicar estes efeitos.
Hipotiroidismo é facilmente gerido com levotiroxina e geralmente não é uma causa para descontinuar a amiodarona. O hipertiroidismo ocorre em 3% dos doentes em áreas deficientes em iodo, mas em 20% em áreas em que o iodo é suficiente. Pode ser difícil de reconhecer porque muitos dos sinais típicos mediados adrenérgicos são bloqueados pela amiodarona.
Em doentes que tomam amiodarona, o primeiro mês de tratamento revelou um aumento em T4 (20%-40%), T3 invertido (20%) e TSH, e uma diminuição em T3, que tende a voltar ao normal aos três meses.
Em alguns casos, a recorrência da fibrilação atrial em doentes com terapia de manutenção com amiodarona, exigiu uma avaliação imediata para excluir o hipertiroidismo induzido por amiodarona.
O risco aumentado ocorre em doentes com função tiroideia de base anormal (doença auto-imune, bócio) e em idosos. As mulheres com anticorpos antitiróides positivos correm sete vezes mais riscos por esta complicação.
A recomendação de uma análise de TSH, T4 e T3 no início do tratamento, um mês no início do tratamento e de seis em seis meses depois.
p>O diagnóstico é presumido quando existem níveis aumentados de TSH e diminuídos de T4 e T3. Queremos lembrar aos nossos leitores que o aumento de TSH durante os três meses iniciais após o início do tratamento com amiodarona não é um problema em si porque pode ser um fenómeno transitório – o tratamento com amiodarona pode ser continuado desde que seja adicionada levothyroxina. A triiodotironina também pode ser adicionada por vezes, se os valores de TSH não tiverem diminuído adequadamente. A gestão irá então requerer a assistência de um endocrinologista experiente e a descontinuação da terapia com amiodarona.
Em todos os doentes, os níveis de tirotropina devem ser verificados antes de iniciar a terapêutica com amiodarona e depois todos os meses.
c) Outras áreas – gastrointestinais, hepáticas, cardíacas, oftálmicas, cutâneas
P>Perturbações gastrointestinais tais como náuseas, vómitos, diarreia, ou anorexia são frequentes (30%) na linha de base. Contudo, alguns dos mais temidos efeitos secundários gastrointestinais – hepatite e cirrose hepática – são raros (<3%). É recomendado testar a função hepática no início do tratamento, e depois de seis em seis meses. No início do tratamento, é geralmente observado um aumento das enzimas hepáticas; não se recomenda a retirada do tratamento a menos que os seus valores excedam duas ou três vezes o normal. Esta elevação, segundo certos autores, não é indicativa de ter de parar o medicamento: no entanto, recomenda-se uma monitorização próxima.
Efeitos adversos cardíacos, incluindo bradicardia, foram relatados em 5% dos pacientes, e arritmias ventriculares polimórficas (torsade de pointes) em 1%-2% dos pacientes, especialmente entre os sujeitos com factores de risco para o mesmo. Por conseguinte, um ECG deve ser realizado na linha de base e depois anualmente. Em pacientes com um cardioversor desfibrilador (CDI), a amiodarona pode aumentar a duração do ciclo da taquicardia ventricular, o que pode levar à sua detecção e pode interferir com a eficácia do dispositivo (4).
Finalmente, entre outros efeitos adversos menores, quase 100% dos pacientes que recebem este fármaco há mais de seis meses têm microdeposições de córnea. A sua presença não requer a retirada do tratamento, uma vez que não estão relacionados com a deterioração da acuidade visual. As reacções oculares, tais como neurite óptica, atrofia com perda de visão ou ambas, são mais graves, mas são raras e não há uma causalidade comprovada da amiodarona em relação a estas. A avaliação oftalmológica só é indicada se houver um défice visual.
Outros efeitos secundários relatados incluem fotossensibilidade e pigmentação cutânea azul, que desaparecem após a interrupção do tratamento. No nosso paciente, após completar vários testes e suspeitar que o quadro clínico do paciente correspondia à TPA, a amiodarona foi descontinuada e a terapia com corticosteróides foi iniciada (40-60 mg de dose diária durante seis meses). Com este tratamento, o paciente teve uma recuperação clínica e radiológica satisfatória.
Finalmente, a amiodarona pode causar hipotensão em aproximadamente 15% dos pacientes que a recebem por via intravenosa. A hipotensão pode ser tratada inicialmente diminuindo a taxa de infusão.
Figure 1A. Radiografias póstero-anteriores do tórax tomadas no momento da apresentação clínica e após três meses de tratamento. Amiodarona infiltra-se nos campos pulmonares basais bilaterais alveolares; contudo, os meios de comunicação desapareceram no seguimento (imagem mais abaixo).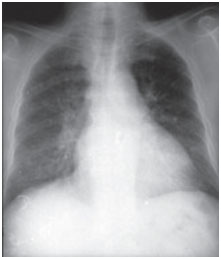
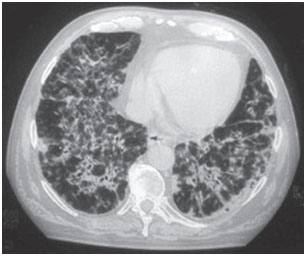
 br>Figure 1B. Tomografia computorizada de tórax – no mesmo paciente, bilateral e difusa, amostra infiltrada alveolointersticial com áreas de broncograma aéreo.
br>Figure 1B. Tomografia computorizada de tórax – no mesmo paciente, bilateral e difusa, amostra infiltrada alveolointersticial com áreas de broncograma aéreo.