INTRODUÇÃO DE ANIDRIDOS ÁCIDOS
Esta página explica o que são anidridos ácidos e analisa as suas propriedades físicas simples, tais como os pontos de ebulição. Introduz a sua reactividade química de uma forma geral, mas detalhes de reacções específicas são dados em páginas separadas – ver o menu anidridos ácidos (link no fundo da página).
O que são anidridos ácidos?
A estrutura dos anidridos ácidos
Um ácido carboxílico como o ácido etanóico tem a estrutura:
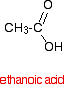
Se pegasse em duas moléculas de ácido etanóico e removesse uma molécula de água entre elas, obteria o anidrido ácido, anidrido etanóico (antigo nome: anidrido acético).
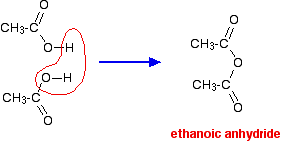
Pode-se de facto fazer anidrido etanóico desidratando o ácido etanóico, mas este é normalmente feito de uma forma mais eficiente e redonda. (Fazer anidrido etanóico está para além do âmbito do UK A level.)
Nomear anidrido ácido
Isto é realmente fácil. Basta pegar no nome do ácido pai, e substituir a palavra “ácido” por “anidrido”. “Anidrido” significa simplesmente “sem água”.
Então . . . o ácido etanóico forma anidrido etanóico; o ácido propanóico forma anidrido propanóico, e assim por diante.
Para fins de nível A no Reino Unido, o único com que se pode deparar é o anidrido etanóico.
Propriedades físicas do anidrido ácido
Consideraremos o anidrido etanóico como típico.
Aspecto
Anidrido etanóico é um líquido incolor, cheirando fortemente a vinagre (ácido etanóico).
O cheiro é porque o anidrido etanóico reage com vapor de água no ar (e humidade no nariz) para produzir ácido etanóico novamente. Esta reacção com água é dada em detalhe noutra página. (Encontra-o no menu anidrido ácido – link no fundo desta página.)
Solubilidade na água
Anidrido etanóico não se pode dizer que se dissolva na água porque reage com ele para dar ácido etanóico. Não existe uma solução aquosa de anidrido etanóico.
Ponto de ebulição
Anidrido etanóico ferve a 140°C. Isto porque é uma molécula polar bastante grande e assim tem forças de dispersão van der Waals e atracções dipolo-dipolo.
Não forma, contudo, ligações de hidrogénio. Isso significa que o seu ponto de ebulição não é tão elevado como um ácido carboxílico de tamanho semelhante. Por exemplo, o ácido pentanóico (o ácido de tamanho mais semelhante) ferve a 186°C.