Esterificazione
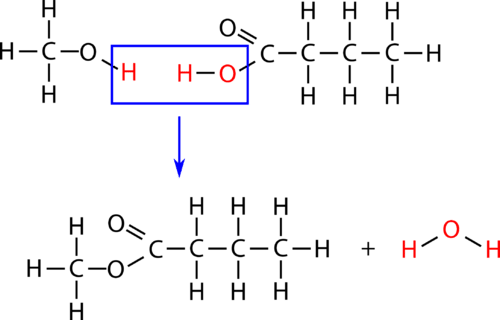
Un’esterificazione è una reazione di condensazione in cui si forma un estere da un alcol e un acido carbossilico. L’esterificazione è una sottocategoria delle reazioni di condensazione perché una molecola d’acqua è prodotta nella reazione. La reazione è catalizzata da un acido forte, di solito acido solforico. Quando l’acido carbossilico butanoico viene riscaldato con un eccesso di metanolo e qualche goccia di acido solforico, si produce il butanoato di metile estere. Il butanoato di metile ha il profumo dell’ananas. La reazione è mostrata qui sotto con entrambe le formule molecolari e strutturali.
La reazione di esterificazione è reversibile. Quando un estere è riscaldato in presenza di una base forte come l’idrossido di sodio, l’estere si rompe. I prodotti sono un alcool e la base coniugata dell’acido carbossilico come sale.
\
L’idrossido di sodio non agisce come catalizzatore, ma viene consumato nella reazione.
La saponificazione descrive la reazione di idrolisi alcalina di un estere. Il termine saponificazione descrive originariamente l’idrolisi di esteri a catena lunga chiamati esteri di acidi grassi per produrre molecole di sapone, che sono i sali degli acidi grassi. Una di queste molecole di sapone è lo stearato di sodio, formato dall’idrolisi dello stearato di etile.
\