Obiettivi di apprendimento
Dopo aver completato questa sezione, dovresti essere in grado di
-
- scrivere un’equazione per rappresentare la formazione di un sapone.
- identificare la struttura del grasso necessaria per produrre un dato sapone.
- identificare la struttura di un sapone, data la struttura del grasso da cui è prodotto.
- descrivere il meccanismo con cui i saponi esercitano la loro azione detergente.
- dare una spiegazione chimica dei problemi incontrati quando i saponi carbossilati sono usati in zone con acqua dura, e spiegare come possono essere superati dall’uso di detergenti solfonati.
Termini chiave
Assicurati di poter definire, e usare nel contesto, i termini chiave che seguono.
- idrofilo
- lipofilo (idrofobo)
- ampifilo
- micelle
Gli acidi carbossilici e i sali con catene alchiliche più lunghe di otto carboni mostrano un comportamento insolito in acqua a causa della presenza di regioni sia idrofile (CO2) che idrofobe (alchiliche) nella stessa molecola. Tali molecole sono chiamate anfifile (Gk. amphi = entrambi) o anfipatiche. Gli acidi grassi composti da dieci o più atomi di carbonio sono quasi insolubili in acqua e, a causa della loro minore densità, galleggiano sulla superficie quando vengono mescolati con l’acqua. A differenza della paraffina o di altri alcani, che tendono ad accumularsi sulla superficie dell’acqua, questi acidi grassi si diffondono uniformemente su una superficie estesa dell’acqua, formando alla fine uno strato monomolecolare in cui i gruppi carbossilici polari sono legati a idrogeno all’interfaccia dell’acqua, e le catene idrocarburiche sono allineate insieme lontano dall’acqua. Questo comportamento è illustrato nel diagramma sulla destra. Le sostanze che si accumulano sulle superfici dell’acqua e ne cambiano le proprietà superficiali sono chiamate tensioattivi.
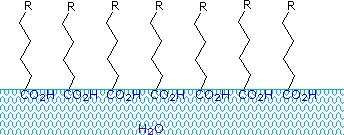
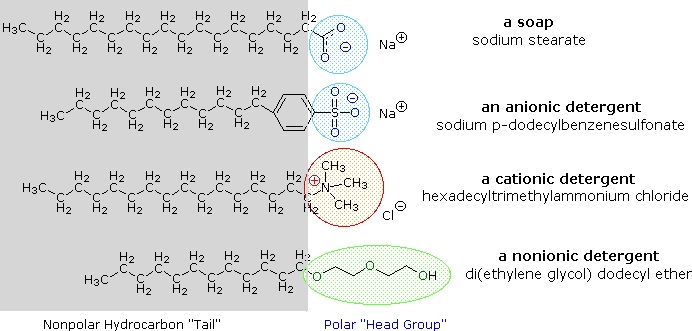
I sali di metalli alcalini degli acidi grassi sono più solubili in acqua degli acidi stessi, e il carattere anfifilico di queste sostanze le rende anche forti tensioattivi. Gli esempi più comuni di tali composti sono saponi e detergenti, quattro dei quali sono mostrati qui sotto. Si noti che ciascuna di queste molecole ha una catena idrocarburica non polare, la “coda”, e un “gruppo di testa” polare (spesso ionico). L’uso di tali composti come agenti di pulizia è facilitato dal loro carattere tensioattivo, che abbassa la tensione superficiale dell’acqua, permettendole di penetrare e bagnare una varietà di materiali.
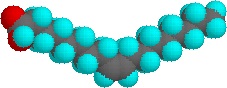
Piccole quantità di questi tensioattivi si dissolvono in acqua per dare una dispersione casuale di molecole solute. Tuttavia, quando la concentrazione viene aumentata, si verifica un cambiamento interessante. Le molecole di tensioattivo si assemblano reversibilmente in aggregati polimolecolari chiamati micelle. Riunendo le catene idrofobiche nel centro della micella, la distruzione della struttura a legame idrogeno dell’acqua liquida è minimizzata, e i gruppi di testa polari si estendono nell’acqua circostante dove partecipano al legame idrogeno. Queste micelle sono spesso di forma sferica, ma possono anche assumere forme cilindriche e ramificate, come illustrato a destra. Qui il gruppo di testa polare è designato da un cerchio blu, e la coda non polare è una linea nera a zig-zag.
Il più antico agente pulente anfifilico conosciuto dall’uomo è il sapone. Il sapone è prodotto dall’idrolisi (saponificazione) catalizzata dalla base del grasso animale (vedi sotto). Prima che l’idrossido di sodio fosse disponibile in commercio, veniva usata una soluzione bollente di carbonato di potassio lisciviato dalle ceneri del legno. I saponi di potassio morbidi venivano poi convertiti in saponi di sodio più duri mediante lavaggio con soluzione salina. L’importanza del sapone per la civiltà umana è documentata dalla storia, ma alcuni problemi associati al suo uso sono stati riconosciuti. Uno di questi è causato dalla debole acidità (pKa circa 4,9) degli acidi grassi. Le soluzioni di saponi di metalli alcalini sono leggermente alcaline (pH 8-9) a causa dell’idrolisi. Se il pH di una soluzione di sapone viene abbassato da contaminanti acidi, gli acidi grassi insolubili precipitano e formano una schiuma. Un secondo problema è causato dalla presenza di sali di calcio e magnesio nell’approvvigionamento idrico (acqua dura). Questi cationi divalenti causano l’aggregazione delle micelle, che poi si depositano come una schiuma sporca.
Questi problemi sono stati alleviati dallo sviluppo di anfifili sintetici chiamati detergenti (o syndet). Usando un acido molto più forte per il gruppo di testa polare, le soluzioni acquose dell’anfifilo sono meno sensibili ai cambiamenti di pH. Anche le funzioni di solfonato usate per quasi tutti i detergenti anionici conferiscono una maggiore solubilità alle micelle che incorporano i cationi alcalino-terrosi che si trovano nell’acqua dura. Variazioni sul tema degli anfifili hanno portato allo sviluppo di altre classi, come i detergenti cationici e non ionici mostrati sopra. I detergenti cationici mostrano spesso proprietà germicide, e la loro capacità di cambiare il pH superficiale li ha resi utili come ammorbidenti per tessuti e balsami per capelli. Questi versatili “strumenti” chimici hanno trasformato drasticamente i mercati dei prodotti per la pulizia della casa e della cura personale negli ultimi cinquant’anni
Reazioni chimiche di grassi e oli
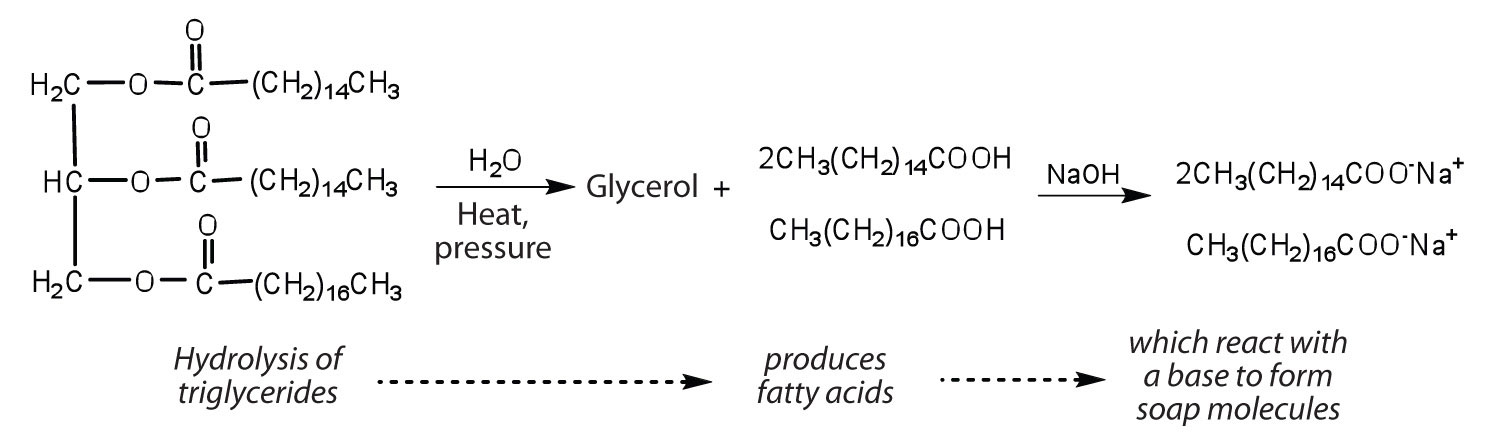
Grassi e oli possono partecipare a una varietà di reazioni chimiche – per esempio, poiché i trigliceridi sono esteri, possono essere idrolizzati in presenza di un acido, una base o enzimi specifici noti come lipasi. L’idrolisi dei grassi e degli oli in presenza di una base è usata per fare il sapone ed è chiamata saponificazione. Oggi la maggior parte dei saponi sono preparati attraverso l’idrolisi dei trigliceridi (spesso dal sego, dall’olio di cocco o da entrambi) usando acqua ad alta pressione e temperatura. Il carbonato di sodio o l’idrossido di sodio vengono poi utilizzati per convertire gli acidi grassi nei loro sali di sodio (molecole di sapone):
Contributori e attribuzioni
-
Dr. Dietmar Kennepohl FCIC (Professore di Chimica, Athabasca University)
-
Prof. Steven Farmer (Sonoma State University)
-
William Reusch, professore emerito (Michigan State U.), Virtual Textbook of Organic Chemistry
- The Basics of General, Organic, and Biological Chemistry di David W. Ball, John W. Hill, and Rhonda J. Scott.