Annals of Neurosciences, Volume 15, Issue 4 (October), 2008
Anurag Tripathi1, UC Srivastava2
1Dipartimento di Zoologia, Ranchi College,(Ranchi University) Ranchi
2Dipartimento di Zoologia, Università di Allahabad, Allahabad, India – 211 002
Autore Correlatore
Dr UC Srivastava
Professore di Zoologia
Dipartimento di Zoologia, Università di Allahabad
Allahabad, India – 211 002
Phone : 93351 20178
E-mail : [email protected]
(Data di ricezione: 08.09.2008)
Abstract
L’acetilcolinesterasi (AChE) termina la neurotrasmissione nelle sinapsi colinergiche scindendo il neurotrasmettitore acetilcolina. La natura e la distribuzione dell’enzima sono state ampiamente studiate in molti invertebrati e vertebrati, compreso l’uomo, a livello istochimico e biochimico. L’enzima dimostra un alto grado di variabilità nella distribuzione con la sua notevole presenza anche in tessuti non neuronali, il che fornisce un tema pertinente per indagare il suo ruolo non classico.
Di recente sono uscite molte informazioni riguardanti la sua struttura dinamica, l’espressione genica, il suo ruolo nella morfogenesi neuronale e la sinaptogenesi. L’importanza dell’AChE deriva dal fatto che è il bersaglio di farmaci progettati per trattare la miastenia gravis, il glaucoma, la malattia di alzheimer ecc.
Tenendo in considerazione i fatti sopra menzionati, nel presente articolo è stata fatta una revisione approfondita della sua biochimica, dinamica strutturale, ampia distribuzione, isoforme e le sue implicazioni nei disturbi neurodegenerativi.
parole chiave : Acetilcolinesterasi, colinergica, forme molecolari, disturbi neurodegenerativi, malattia di Alzheimer.
Introduzioni
L’acetilcolinesterasi (AChE) è uno degli enzimi più efficienti del sistema nervoso che si concentra nelle sinapsi colinergiche e nelle sinapsi neuromuscolari dove idrolizza rapidamente il neurotrasmettitore acetilcolina (Ach) in colina e acetato giocando così un ruolo essenziale nella neurotrasmissione colinergica.
Il termine acetilcolinesterasi fu introdotto nel 1949 da Augustintion e Nachmansohn per indicare una colinesterasi specifica capace di idrolizzare l’acetilcolina più velocemente delle altre esterasi. Nel 1964 la commissione di enzimologia raccomandò il nome “Acetilcolinesterasi” (Acetylcholine Acetyl hydrolase; 3.1.1.7) per una vera e specifica colinesterasi.
La distribuzione dell’enzima nei tessuti nervosi centrali e periferici di diversi vertebrati dimostra un alto range di variazione (1-13). È stato notato che è localizzato anche in tessuti non neuronali e nelle cellule gliali (14, 15). L’enzima mostra anche una diversità molecolare con le sue sei diverse forme molecolari e dinamiche strutturali che facilitano la sua affinità e azione con varie legende (16-17). Inoltre, AChE è considerato svolgere diversi ruoli non classici indipendenti dalla sua funzione catalitica, cioè l’idrolisi di Ach. Questi ruoli classici e non classici dell’AChE illustrano adeguatamente la sua ampia presenza nei tessuti neuronali e non neuronali (18-20).
L’importanza delle AChE nell’omeostasi del corpo è sottolineata dal fatto che sono i bersagli di alcune delle tossine più potenti tra cui insetticidi, veleno di serpente e armi chimiche (21).
Quindi una così ampia distribuzione e varie funzioni, forme molecolari, dinamiche strutturali ecc. dell’AChE forniscono una base adeguata per ricordarlo come un enzima versatile, la cui conoscenza dettagliata aiuterà a progettare farmaci specifici per combattere varie malattie neurodegenerative associate a questo enzima.
Biochimica e dinamica strutturale
La struttura tridimensionale dell’AChE fu determinata per la prima volta da Joel Sussman et al. nel 1991, usando la proteina di T. californica (22). Le strutture dei domini catalitici delle AChE di specie come T. californica, topo e uomo sono abbastanza simili (fig.1) (23, 24).
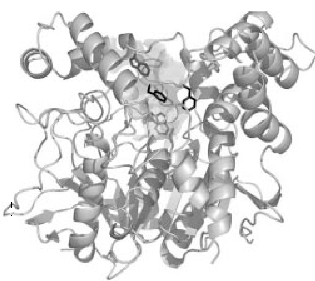
Figura 1. Diagramma a nastro tridimensionale dell’acetilcolinesterasi di Torpedo Californica.
L’acetilcolinesterasi è una serina idrolasi appartenente alla famiglia delle corbossilesterasi di tipo B negli eucarioti superiori. È una molecola ellissoidale di circa 45× 60×65 A0, che consiste in un foglio beta misto a 12 filamenti circondato da 14 eliche alfa. (22). È un monomero nel suo stato naturale con un peso molecolare di circa 60.000 e forma aggregati che continuano a produrre attività catalitica.
Il sito attivo è composto da due sottositi, il sottosito esterico con la triade catalitica (Ser-His-Glu) e il sottosito anionico di legame periferico (PAS) che ospita il polo quaternario positivo dell’Ach. ( Fig. 2a)
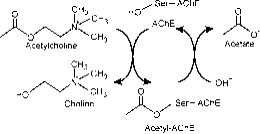
Figura 2a: Diversi siti di AChE; il sito catalitico si trova in una gola profonda.
Il sottosito esterico contiene il macchinario catalitico dell’enzima, una triade di Ser 200, His-440 e Glu-327 (i numeri indicano la sequenza di amminoacidi nella catena polipeptidica). Questa triade è simile ad altre serino-proteasi, tranne che la triade è la prima a mostrare Glu come terzo membro al contrario di Asp. Inoltre la triade è di mano opposta a quella delle altre proteasi. Il sottosito anionico è definito da Trp 84, Phe 330, Phe 331. Il suo ruolo è quello di orientare la parte carica del substrato che entra nel sito attivo. Questo viene svolto principalmente da Trp. 84 (22).
La gola aromatica nella proteina è profonda circa 20 angstrom e penetra per metà l’enzima. Il sito attivo si trova alla base di questa gola solo 4 angstrom sopra la base. Gola aromatica è il termine più appropriato perché il 40% del suo rivestimento è composto da 14 residui aromatici che sono altamente conservati da diverse specie di AChE (25).
Il sito anionico periferico ha la capacità di legarsi a molti tipi diversi di ligandi e questo influenza la conferma del sito attivo. Sei residui stabilizzano l’attività all’interno del sito. Trp 286, Ty r 72, Tyr 124, Glu 285, Asp 74, Tyr 341 situato sul sito opposto dell’entrata della gola. Questo array di residui fornisce flessibilità che accoglie molti ligandi e implica anche la loro mobilità di conferma. AChE catalizza l’idrolisi di AChE nel seguente modo (Fig. 2b):
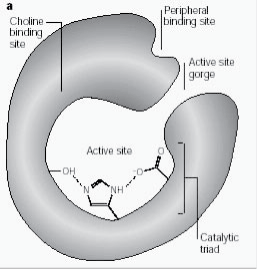
Figura 2b: Reazione del substrato enzimatico che illustra l’idrolisi dell’acetilcolina.
La dinamica molecolare di AChE è mantenuta attraverso il meccanismo del cross talk in cui l’interazione tra due sottositi avviene in particolare tra i residui Trp 286, Trp 86. Quando Trp 286 è legata alla periferia, influisce su Trp 86 nel sito attivo e causa un sito di conferma distinto. Asp 74 gioca anche un ruolo nella modulazione allosterica dell’enzima. La sensibilità di questi residui e la plasticità del sito attivo sono probabilmente il risultato di una progettazione evolutiva volta a conferire un’attività ottimale in una vasta gamma di condizioni (26.)
Eccursione
L’enzima AChE è presente in alta concentrazione in tutti i tipi di tessuti conduttori, nervosi e muscolari, tessuti centrali e periferici, fibre motorie e sensoriali, fibre simpatiche e parasimpatiche cosiddette colinergiche e non colinergiche e in tutte le regioni in cui si trovano corpi e giunzioni cellulari, la concentrazione dell’enzima è alta (27). Con metodi istochimici, l’AChE è generalmente dimostrata nelle strutture neuronali: perikarya, membrane di superficie, assoni, dendriti e regioni sinaptiche 4, 15, 28-30). L’attività dell’AChE è maggiore nei neuroni motori che nei neuroni sensoriali (4, 15, 31). L’acetilcolinesterasi nei tessuti nervosi è generalmente riconosciuta per rappresentare i neuroni che contengono e presumibilmente rilasciano acetilcolina come neurotrasmettitore (32).
I primi studi sul sito di sintesi dell’AChE all’interno del tessuto nervoso hanno indicato un’origine all’interno del corpo cellulare del neurone (33-35). L’enzima è stato trovato associato al reticolo endoplasmatico del corpo cellulare e all’apparato di Golgi (8, 36). L’AChE è stato anche associato nelle frazioni subcellulari del cervello con frazioni microsomiali e mitocondriali grezze (2, 37). Un ulteriore frazionamento della frazione mitocondriale grezza dal tessuto cerebrale ha mostrato alti livelli di attività AChE nella frazione di membrana sinaptosomiale (6).
Il grosso dell’AChE è stato trovato localizzato negli assoni e associato alla membrana assonale (9). L’attività della colinesterasi limitata agli assoni è stata osservata sulle vescicole assonali di tutte le fibre nervose non mielinizzate e di alcune mielinizzate (38). Le fibre nervose mielinizzate in generale hanno una concentrazione più bassa delle cosiddette non mielinizzate e la materia bianca contiene molto meno AChE della materia grigia (27). Nei motoneuroni isolati, l’attività dell’AChE è circa dieci volte maggiore nel citoplasma, nei dendriti e negli assoni che nel nucleoplasma e nessuna attività è presente nel nucleolo (39). È stato dimostrato che le cellule gliali contengono AChE in concentrazioni variabili (14, 15)
Ruoli classici e non classici
L’intero corso della trasmissione colinergica, in particolare alla giunzione neuromuscolare, cioè il rilascio di Ach, la sua diffusione attraverso la fessura sinaptica, la sua interazione reversibile con il recettore nicotinico Ach e infine l’idrolisi da parte di AChE avviene in pochi millisecondi. L’intero processo è strettamente integrato sia spazialmente che temporalmente (40). In accordo con il suo ruolo classico, il suo tempo di rotazione è di 150 usec, che è equivalente all’idrolisi di 5000 molecole di Ach/molecola di enzima/sec. Idrolizza il substrato così rapidamente che la concentrazione intorno alla molecola dell’enzima è impoverita rispetto alla sua concentrazione nella soluzione bulk.
Da oltre vent’anni, si suppone che AChE svolga altri ruoli, oltre a quello classico di terminare la trasmissione sinaptica. Queste funzioni non classiche di AChE potrebbero coinvolgere l’idrolisi di Ach in un contesto non sinaptico. Il peptide terminale C di 26 residui ARP (acetilcolinesterasi read through peptide) dell’AChE umana, che viene prodotto quando la variante splice R è indotta dallo stress, è stato riportato per modulare la differenziazione ematopoitica (41).
Vari studi in vivo e in vitero nel sistema nervoso centrale hanno suggerito che l’enzima AChE regolato nello sviluppo gioca un ruolo nella funzione non colinergica come i processi morfometrici, la differenziazione cellulare e la sinaptogenesi lungo il sistema nervoso (20). Ci sono ampi studi che suggeriscono che uno dei ruoli non classici di AChE può essere come proteina di adesione coinvolta nello sviluppo e nel mantenimento sinaptico (42). Alcune altre evidenze implicano che AChE sia una proteina della matrice ossea, ed è stato recentemente dimostrato che interagisce con la proteina del basamento, la laminina (43, 44).
Diversi studi hanno dimostrato che AChE è coinvolta nella crescita dei neuriti. Forme di AChE che idrolizzano Ach ma mancano del corboxy-terminale (responsabile delle attività neuritogeniche), i domini neuritici non sono riusciti a migliorare la crescita neuritica dimostrando l’indipendenza dell’attività catilitica e neuritogenica l’una dall’altra (19). AChE è stato anche proposto di svolgere ruoli multipli nell’embriogenesi. Il pesce zebra fornisce un sistema eccellente per indagare i ruoli invivo di AChE durante l’embriogenesi. È stata identificata una mutazione di missence nel gene ache del pesce zebra che abolisce l’idrolisi di Ach ma lascia intatto il corboxy-terminale neuritogenico (45). Nel caso in cui gli embrioni mutanti ache sono stati segnalati anche per avere difetti nello sviluppo delle fibre muscolari e la sopravvivenza dei neuroni sensoriali primari e la crescita dendritica. Questi difetti sono stati interpretati collettivamente per sostenere ruoli non classici di AChE.
Ci sono ampie prove a sostegno del suo ruolo nell’idrolisi della sostanza P, met, leu-enkephaline e nella degradazione di altri neuropeptidi (46, 47).
AChE è stata anche proposta per funzionare nella morfogenesi del cuore. L’attività di AChE è rilevata nei cuori embrionali di ratto e di pollo prima dell’innervazione (48, 49). Anche se il suo ruolo nel cuore embrionale non è chiaro, AChE è stato proposto per regolare un sistema embrionale di conduzione degli impulsi (50). Tuttavia sono necessarie ulteriori funzioni per esplorare ulteriormente il ruolo di AChE nella funzione cardiaca.
AChE ha dimostrato di accelerare l’assemblaggio del peptide αβ in fibrille amiloidi probabilmente attraverso l’interazione nel sito periferico (51-53).È stato anche dimostrato che i complessi AChE / αβ mostrano una maggiore neurotossicità rispetto alle fibrille contenenti solo αβ (54).
In un contesto farmacologico gli studi hanno rivelato che le attività non classiche di AChE sembrano convergere sul sito anionico periferico. Si potrebbe quindi prevedere che nuove categorie di inibitori dell’AChE saranno sviluppate in futuro.
Diversità molecolare
L’enzima AChE si presenta in una serie di forme molecolari che differiscono sia per la struttura quaternaria che per la modalità di ancoraggio all’interno della sinapsi generata dallo splicing alternato dell’esone terminale C di un singolo gene, seguito da modifiche post-traslazionali (55, 56). L’acetilcolinesterasi (AChE) esiste in sei forme diverse (isoenzimi): monomero globulare (G1), dimero (G2) e tetramero (G4); tetramero con coda (A4), tetramero con doppia coda (A8) e tetramero con tripla coda (A12) (fig.3). La terminologia più razionale basata su queste informazioni è quella sviluppata da Bon et al. (1982). Nel loro sistema le forme globulari sono designate da “G” e le forme con la coda da “A”.
Le forme di dimero legate al disolfuro possono essere solubili o attaccate a una membrana da un glicofosfolipide. Le forme tetramero possono essere solubili, legate a lipidi alla membrana o attaccate a una tripla elica di collagene. Le forme monomeriche sono generalmente incorporate nelle sinapsi del sistema nervoso centrale dei vertebrati, mentre nelle giunzioni neuromuscolari tre subunità catalitiche dei tetrameri sono attaccate a una coda di collagene a tripla elica che ancorano poi alla lamina basale nella fessura sinaptica.
L’espressione delle forme molecolari di AChE, in Torpedo, è stata osservata essere tessuto-specifica suggerendo che il polimorfismo esibito da AChE dipende da una serie di fattori tra cui
quantità di Ach rilasciato
dimensione dello spazio sinaptico e/o
corso temporale della stimolazione fisiologica.(58)
Regolazione dell’espressione di AChE nei neuroni
Negli ultimi anni ci sono stati studi approfonditi per svelare i meccanismi molecolari e i percorsi coinvolti nell’espressione e nella localizzazione di AChE nei tessuti neuronali e non. AChE è altamente espresso durante la differenziazione neuronale. È stato osservato che l’AChE – regione non tradotta 3′ (UTR) contiene un elemento ricco di AU (ARE) che interagisce direttamente con la proteina legante l’RNA ‘HuD’ con conseguente abbondanza di trascrizioni di AChE nelle cellule neuronali (59). Questi risultati mostrano l’importanza dei meccanismi post-trascrizionali nella regolazione dell’espressione di AChE nei neuroni in fase di differenziazione e implicano “HuD” come un fattore chiave che agisce in modo transitorio in questi eventi. Tuttavia, in aggiunta, molti altri fattori di regolazione governano la stabilità, la localizzazione e la traduzione dei trascritti di AChE. Molti elementi di azione cis e fattori e proteine di azione trans interagiscono con AChE – 3′-UTR. (59).
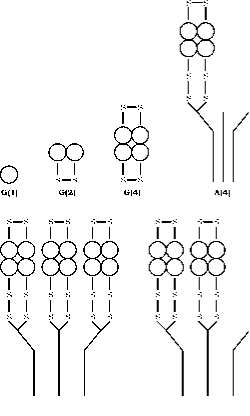
Figura 3. Struttura trimestrale delle sei forme principali di AChE. Le forme globulari sono rappresentate da G e le forme asimmetriche da A secondo lo schema di Bon et. al. (16). La posizione dei ponti disolfuro e la modalità di legame alla coda del collagene sono schematizzati secondo il modello costruito da Anglister e Silman.(57)
AChE nei disturbi neurodegenerativi e neuromuscolari :
L’acetilcolinesterasi è stata direttamente collegata a certi disturbi neuromuscolari come la miastenia gravis, il glaucoma (60), e più recentemente per alleviare il deficit colinergico associato alla malattia di alzheimer (61).
Clinicamente, l’inibizione moderata di AChE è efficace nel trattamento di queste malattie per prolungare l’effetto dell’ACh sul recettore Tale trattamento è auspicabile sia se c’è una ridotta concentrazione di ACh, come nel caso della malattia di Alzheimer, o se ci sono meno recettori, come nel caso della miastenia gravis. Gli inibitori attualmente approvati dalla FDA per il trattamento della malattia di Alzheimer sono E2020 (donepezil, Aricept), tacrina (Cognex), rivastigmina (Exelon) e galantamina (Reminyl)(62). Gli inibitori per il trattamento della miastenia gravis includono la piridostigmina (Mestinon) e la neostigmina (Prostigmina (63). Tuttavia, l’inibizione schiacciante di AChE, in particolare attraverso il legame covalente alla serina del sito attivo, è invariabilmente letale. Quindi, l’AChE è un obiettivo primario per le tossine naturali come il fasciculina II del veleno di serpente, i pesticidi come il parathion e il malathion, e gli agenti di guerra chimica come il sarin, il tabun e il VX (64)
Conclusioni
Nel presente articolo, abbiamo prima esaminato i recenti risultati relativi alla biochimica e alla struttura molecolare dell’AChE che fornisce l’enzima unico, la flessibilità per incontrare diverse leggende e anche per esibire un alto tasso di turn over. Abbiamo anche illustrato il suo ampio modello di distribuzione istochimica nei tessuti neuronali e non neuronali che può essere ulteriormente correlato ai suoi ruoli classici e non classici che sono stati rivisti. Ulteriori studi sulla regolazione dell’espressione di AChE, che svelano l’importanza di questi eventi post-trascrizionali in vivo sono di estrema importanza perché in definitiva questi potrebbero portare alla progettazione di ulteriori strategie terapeutiche volte a promuovere la rigenerazione e la sopravvivenza neuronale. I recenti sviluppi nella biologia di AChE, in particolare le sue implicazioni in alcuni disturbi neurodegenerativi, sono di fondamentale interesse e sono stati rivisti brevemente. Questa ricerca sta portando alla produzione di nuove classi di inibitori AChE mirati contro i suoi PAS (siti anionici periferici), che potrebbero svolgere un doppio ruolo nel contesto della malattia di Alzheimer inibendo simultaneamente l’idrolisi dell’acetilcolina e ritardando l’assemblaggio del peptide â â alla fibra amiloide.
Abbreviazioni
AChE – acetilcolinesterasi; ARP – acetilcolinesterasi read through peptide; Ach – acetilcolina; UTR – regione non tradotta; ARE – AU rich element; PAS – sito anionico periferico; Glu – acido glutammico; His – istidina; Ser – serina; Asp – acido aspartico; Trp – triptofano; Tyr – tirosina; Phe – fenilalanina.