1. Morfologia
2. Funzioni
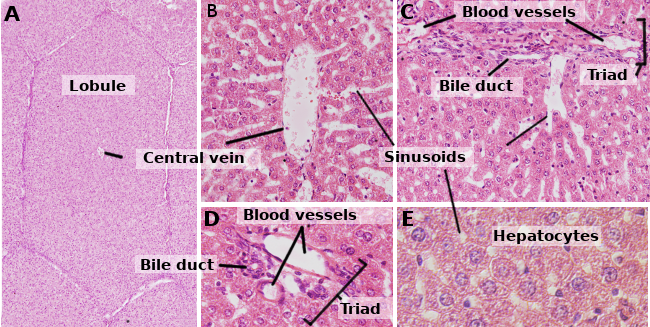
Gli epatociti sono le cellule del fegato, che rappresentano circa l’80% di questo organo. Sono organizzati in fogli di circa una cellula di spessore. I fogli sono collegati tra loro formando una struttura spugnosa (figure 1 e 2). Gli epatociti sono cellule piuttosto longeve, che si rinnovano ogni 5 mesi circa. Tuttavia, può cambiare in processi rigenerativi in cui gli epatociti mostrano un’alta capacità di proliferazione e rigenerazione del tessuto epatico danneggiato.

Morfologia
Gli epatociti sono cellule poliedriche, cioè hanno diverse facce. Di solito mostrano 6 facce, ma il numero può variare. Le facce sono in contatto con altri epatociti o con un sinusoide (Figura 3). Gli epatociti sono cellule grandi, di circa 20-30 µm di diametro. Mostrano un nucleo rotondo centrato nel citoplasma. Tuttavia, nel fegato di esseri umani adulti, fino al 25% degli epatociti può essere binucleato (Figura 2). La maggior parte dei nuclei sono tetraploidi, quindi contengono una quantità doppia di DNA rispetto a una cellula ordinaria. La dimensione dei nuclei è variabile, anche se sono più grandi nelle cellule tetraploidi. I nuclei mostrano eterocromatina sparsa e uno o più nucleoli. Non è comune osservare epatociti mitotici (1 ogni 10000 o 20000 epatociti) in condizioni normali. Tuttavia, gli epatociti mitotici aumentano enormemente in caso di lesioni epatiche e processi di rigenerazione. Le caratteristiche del citoplasma variano a seconda dello stato fisiologico della cellula, principalmente influenzato dai depositi di grasso e glicogeno. Ci sono molti piccoli mitocondri, da 800 a 100 per epatocita. Si stima che un epatocita possa contenere circa 50 apparati di Golgi che sono solitamente organizzati in pile di 3-5 cisterne che mostrano regioni laterali ispessite contenenti corpi scuri. Le pile di cisterne sono in qualche modo sparse nel citoplasma, anche se sono spesso osservate vicino ai canalicoli billiari (figure 3 e 4). Gli epatociti contengono molti perossisomi (da 200 a 300), più delle altre cellule regolari. Vicino ai canalicoli billiari, si trovano anche molti lisosomi.


Nel citoplasma degli epatociti si trovano abbondanti depositi di glicogeno e lipidi (l’aspetto granulare degli epatociti dopo la colorazione con ematossilina ed eosina è dovuto ai fori lasciati dall’estrazione di lipidi dal citoplasma durante la lavorazione del tessuto). Nel citoplasma ci sono anche corpi residui contenenti lipofuscina. Il reticolo endoplasmatico liscio è abbastanza abbondante, anche se la dimensione dell’organello varia con l’attività metabolica dell’epatocita. È concentrato intorno ai depositi di glicogeno. Nei lobuli epatici, ci sono differenze morfologiche quando si confrontano gli epatociti periferici e centrali, per lo più influenzati dalle caratteristiche del sangue. Per esempio, dopo la digestione, gli epatociti periferici sono i primi a immagazzinare glicogeno, ma gli ultimi a mobilizzarlo quando il resto del corpo lo richiede. Tuttavia, l’immagazzinamento dei grassi avviene prima negli epatociti centrali, che di solito hanno un reticolo endoplasmatico più liscio. D’altra parte, il reticolo endoplasmatico ruvido mostra il 50% di superficie in più negli epatociti periferici e medi che in quelli della parte interna del lobulo epatico.
A differenza di altre cellule epiteliali, gli epatociti non sono legati a una membrana basale. Le loro membrane basolaterali sono circondate da una matrice extracellulare a bassa densità sintetizzata dagli epatociti stessi. Essa facilita la diffusione e lo scambio di molecole con i sinusoidi attraverso lo spazio di Disse, o spazi perisinousoidali, che è lo spazio tra l’endotelio fenestrato e gli epatociti. Questa matrice extracellulare manca di laminina, almeno quando l’epatocita è differenziato. Tuttavia, il collagene di tipo IV e la fibronectina sembrano necessari per una corretta differenziazione degli epatociti. Gli epatociti sono collegati tra loro da gap junctions, giunzioni aderenti, desmosomi e giunzioni strette.
Gli epatociti sono cellule polarizzate, cioè ci sono differenze tra le regioni rivolte verso i canalicoli biliari e le regioni vicine ai sinusoidi. La polarità è essenziale per il corretto funzionamento dell’epatocita, ed è disorganizzata in molte patologie epatiche. La regione apicale è in contatto con i canalicoli biliari. Come nel dominio apicale delle cellule epiteliali, ci sono giunzioni strette, che sigillano e mantengono l’integrità dei canalicoli biliari. La membrana apicale si ripiega in microvilli che aumentano enormemente la superficie della membrana. La membrana apicale è circa il 13% della membrana totale dell’epatocita, ed è in grado di contenere una grande quantità di molecole. La rimozione delle giunzioni strette porta alla disorganizzazione della polarità cellulare. La polarità degli epatociti e i canalicoli biliari sono stabiliti durante il periodo di sviluppo embrionale.
La polarità funzionale si basa su una distribuzione ineguale dei trasportatori e di altre molecole di membrana tra il dominio apicale e quello basolaterale della membrana plasmatica. I trasportatori ABC (ATP binding cassette) sono tra i più importanti trasportatori apicali negli epatociti. L’apparato di Golgi, gli endosomi e il citoscheletro (microtubuli e filamenti di actina) sono responsabili della distribuzione differenziale delle molecole tra i due domini di membrana. Ci sono due vie di consegna delle proteine al dominio apicale (Figura 5): dall’apparato di Golgi, le proteine (per esempio, i trasportatori ABC) sono rilasciate in vescicole verso la membrana plasmatica apicale o verso gli endosomi di riciclaggio, che funzionano come intermediari. Altre proteine seguono un percorso di transcitosi, viaggiando prima verso le membrane basolaterali e poi vengono racchiuse in vescicole di endocitosi verso gli endosomi, dove vengono nuovamente impacchettate vescicole e spedite verso la membrana apicale. Più raro è un percorso che coinvolge l’esocitosi dei lisosomi, seguita da trasportatori cooper.

Funzioni
La funzione principale degli epatociti è quella di metabolizzare le sostanze provenienti dalla digestione. Il fegato è irrigato dalla vena porta che raccoglie le molecole provenienti dalla digestione nell’intestino. Gli epatociti sono anche fortemente coinvolti nella disintossicazione di molecole potenzialmente dannose. D’altra parte, gli epatociti sintetizzano la bile, che viene infine rilasciata nell’intestino e aiuta nella digestione. Per entrambe le funzioni, metabolizzare le molecole della digestione e rilasciare la bile, gli epatociti sono posti in una posizione privilegiata: a contatto con i sinusoidi, che portano nell’intestino le molecole digerite, e formano i canalicoli biliari che drenano la bile dai lobuli del fegato.
Livelli di glucosio. Gli epatociti prendono le molecole di glucosio provenienti dalla digestione e le immagazzinano come glicogeno, che viene mobilitato quando il corpo ha bisogno di energia. Il glicogeno si trova comunemente vicino al reticolo endoplasmatico poiché l’enzima glucosio-6-fosfatasi si trova in questo organello. La glucosio-6-fosfatasi catalizza il glucosio-6-fosfato, la forma molecolare del glucosio dopo il catabolismo del glicogeno, e produce glucosio libero, che può uscire dall’epatocita e raggiungere il flusso sanguigno.
Sintesi delle molecole. I sali biliari, che aiutano la digestione dei grassi, sono una delle sostanze sintetizzate dagli epatociti. Nel reticolo endoplasmatico liscio, ci sono molti enzimi coinvolti nella sintesi del colesterolo e di altri lipidi. Inoltre, gli epatociti producono le lipoproteine necessarie per il trasporto dei lipidi nel flusso sanguigno. Anche il fibrinogeno per la coagulazione del sangue e le albumine plasmatiche sono sintetizzate dagli epatociti. Nel fegato, l’urea è prodotta come sottoprodotto della degradazione delle proteine. La produzione e l’accumulo di un’elevata quantità di urea nell’organismo può essere dannosa. Gli epatociti immagazzinano la vitamina A e B e l’eparina.
Metabolismo lipidico. La beta-ossidazione, coinvolta nel catabolismo dei lipidi, lavora negli abbondanti perossisomi degli epatociti.
Disintossicazione. Gli epatociti raccolgono sostanze nutrienti provenienti dalla digestione, ma sono anche i primi a ricevere sostanze potenzialmente tossiche. L’etanolo delle bevande alcoliche è principalmente degradato nel fegato, in realtà nei numerosi perossisomi degli epatociti. Metà dell’alcol ingerito viene trasformato in acetaldeide in questi organelli. Ci sono enzimi nel reticolo endoplasmatico liscio coinvolti nella degradazione o inattivazione di tossine e farmaci. Durante i periodi di alta richiesta di rimozione delle sostanze tossiche, come durante i trattamenti farmacologici o il continuo consumo di alcol, il reticolo endoplasmatico può diventare l’organello più ingombrante dell’epatocita. Le droghe sono solitamente inattivate dalla coniugazione con altre molecole. Per esempio, la glucosiltransferasi coniuga le molecole con i barbiturici.
Immagazzinare e regolare il ferro. Gli epatociti possono lavorare per immagazzinare il ferro, che è concentrato in depositi citoplasmatici legati alla ferritina. Gli epatociti possono catturare il ferro in diversi modi: legato alla transferrina, come parte di gruppi eme e da gruppi non eme. Il ferro della transferrina entra nella cellula attraverso l’endocitosi mediata dal recettore TRF1. Quando le vescicole endocitiche si fondono con gli endosomi, la transferrina rilascia Fe3+, che viene trasformato in F2+ ed estruso nel citosol dal trasportatore DMT1 (divalent metal transporter 1). Anche le molecole di ferro eme sono endocitate e vengono traslocate nel citosol attraverso la membrana endosomiale dal trasportatore HRG1. Tuttavia, la maggior parte del ferro entra dallo spazio extracellulare attraverso il trasportatore ZIP14 posto nella membrana plasmatica degli epatociti di fronte ai sinusoidi. Una volta nel citosol, il ferro è legato alla ferritina e immagazzinato nel citoplasma perché il ferro libero è tossico. Il rilascio del ferro dall’enterocita è mediato dal trasportatore ferroportina che si trova nella membrana plasmatica vicino ai sinusoidi.
Dopo il midollo osseo, il fegato è il secondo maggior centro di produzione di gruppi eme. Il gruppo eme è un gruppo prostetico (non peptidico) presente in diverse proteine per il trasporto dell’ossigeno, in quegli enzimi come le catalasi e le perossidasi che proteggono dalle sostanze ossidanti. Fa anche parte dei citocromi mitocondriali e perossisomiali. La maggiore quantità di gruppi eme si trova nell’emoglobina, che viene sintetizzata nel midollo osseo. Nel fegato, la sintesi dei gruppi eme dipende dalla quantità di citocromo p450 microsomiale necessaria alla cellula, per cui la maggior parte di questi gruppi eme fa parte dei citocromi p450.
Gli epatociti rilasciano l’ormone epcidina, che regola la concentrazione sistemica di ferro nel corpo. Questo ormone controlla la quantità di ferro nel plasma favorendo l’internalizzazione e la degradazione della ferroportina, trasportatore di ferro presente negli enterociti, nei macrofagi e negli apatociti. La rimozione della ferroportina inibisce il rilascio di ferro da queste cellule. La sintesi di epcidina è regolata dalla concentrazione di transferrina-ferro nel plasma, dai depositi di ferro negli epatociti e dall’infiammazione. L’attività eritropoietica inibisce il rilascio di epcidina.
Bibliografia
Gissen P, Arias IM. 2015. Polarità strutturale e funzionale degli epatociti e malattie del fegato. Journal of hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Cellule staminali intestinali adulte: driver critici dell’omeostasi epiteliale e della rigenerazione. Natura recensione in biologia cellulare molecolare. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelona.