Differenza principale – Geometria Elettronica vs Geometria Molecolare
La geometria di una molecola determina la reattività, polarità e attività biologica di quella molecola. La geometria di una molecola può essere data come la geometria degli elettroni o la geometria molecolare. La teoria VSEPR (Valence Shell Electron Pair Repulsion theory) può essere usata per determinare le geometrie delle molecole. La geometria degli elettroni include le coppie di elettroni solitari presenti in una molecola. La geometria molecolare può essere determinata dal numero di legami che una particolare molecola ha. La differenza principale tra la geometria degli elettroni e la geometria molecolare è che la geometria degli elettroni si trova prendendo sia le coppie di elettroni solitari che i legami in una molecola, mentre la geometria molecolare si trova usando solo i legami presenti nella molecola.
Aree chiave trattate
1. Cos’è la geometria degli elettroni
– Definizione, identificazione, esempi
2. Cos’è la geometria molecolare
– Definizione, identificazione, esempi
3. Cosa sono le geometrie delle molecole
– Tabella esplicativa
4. Qual è la differenza tra geometria degli elettroni e geometria molecolare
– Confronto delle differenze chiave
Termini chiave: Geometria degli elettroni, coppia di elettroni solitari, geometria molecolare, Teoria VSEPR

Cos’è la geometria degli elettroni
La geometria degli elettroni è la forma di una molecola prevista considerando sia le coppie di elettroni di legame che le coppie di elettroni solitari. La teoria VSEPR afferma che le coppie di elettroni situate intorno a un certo atomo si respingono a vicenda. Queste coppie di elettroni possono essere sia elettroni di legame che elettroni non di legame.
La geometria degli elettroni dà la disposizione spaziale di tutti i legami e delle coppie solitarie di una molecola. La geometria degli elettroni può essere ottenuta usando la teoria VSEPR.
Come determinare la geometria degli elettroni
I seguenti sono i passi usati in questa determinazione.
- Prevedere l’atomo centrale della molecola. Dovrebbe essere l’atomo più elettronegativo.
- Determinare il numero di elettroni di valenza nell’atomo centrale.
- Determinare il numero di elettroni donati da altri atomi.
- Calcolare il numero totale di elettroni attorno all’atomo centrale.
- Dividere questo numero da 2. Questo dà il numero di gruppi di elettroni presenti.
- Durre il numero di legami singoli presenti intorno all’atomo centrale dal numero sterico ottenuto sopra. Questo dà il numero di coppie di elettroni solitari presenti nella molecola.
- Determina la geometria degli elettroni.
Esempi
Geometria degli elettroni di CH4
Atomo centrale della molecola = C
Numero di elettroni di valenza di C = 4
Numero di elettroni donati dagli atomi di idrogeno = 4 x (H)
= 4 x 1 = 4
Numero totale di elettroni intorno a C = 4 + 4 = 8
Numero di gruppi di elettroni = 8 / 2 = 4
Numero di legami singoli presenti = 4
Numero di coppie di elettroni solitari = 4 – 4 = 0
Quindi, la geometria degli elettroni = tetraedrica
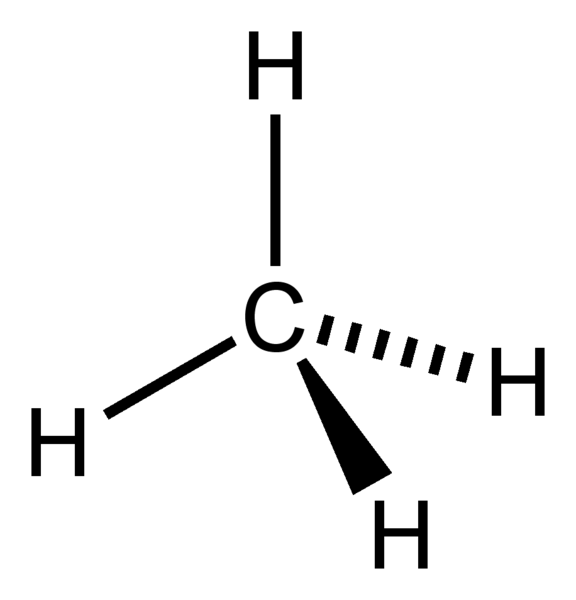
Figura 1: Geometria elettronica del CH4
Geometria elettronica dell’ammoniaca (NH3)
Atomo centrale della molecola = N
Numero di elettroni di valenza di N = 5
Numero di elettroni donati dagli atomi di idrogeno = 3 x (H)
= 3 x 1 = 3
Numero totale di elettroni intorno a N = 5 + 3 = 8
Numero di gruppi di elettroni = 8 / 2 = 4
Numero di legami singoli presenti = 3
Numero di coppie di elettroni solitari = 4 – 3 = 1
Quindi, la geometria degli elettroni = tetraedrica
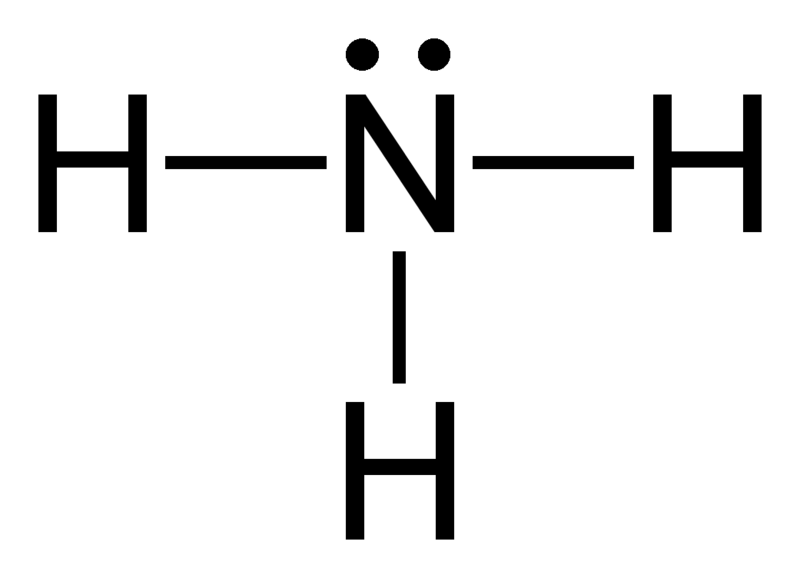
Figura 2: Geometria elettronica dell’ammoniaca
Geometria elettronica di AlCl3
Atomo centrale della molecola = Al
Numero di elettroni di valenza di Al = 3
Numero di elettroni donati dagli atomi di Cl = 3 x (Cl)
= 3 x 1 = 3
Numero totale di elettroni intorno a N = 3 + 3 = 6
Numero di gruppi di elettroni = 6 / 2 = 3
Numero di legami singoli presenti = 3
Numero di coppie di elettroni solitari = 3 – 3 = 0
Quindi, la geometria degli elettroni = trigono planare

Figura 3: Geometria degli elettroni di AlCl3
A volte, la geometria degli elettroni e la geometria molecolare sono le stesse. Questo perché solo gli elettroni di legame sono considerati nella determinazione della geometria in assenza di coppie di elettroni solitari.
Che cos’è la geometria molecolare
La geometria molecolare è la forma di una molecola prevista considerando solo coppie di elettroni di legame. In questo caso, le coppie di elettroni solitari non sono prese in considerazione. Inoltre, i doppi e tripli legami sono considerati come legami singoli. Le geometrie sono determinate in base al fatto che le coppie di elettroni solitari hanno bisogno di più spazio delle coppie di elettroni di legame. Per esempio, se una certa molecola è composta da due coppie di elettroni di legame insieme a una coppia solitaria, la geometria molecolare non è lineare. La geometria è “piegata o angolare” perché la coppia di elettroni solitari ha bisogno di più spazio di due coppie di elettroni di legame.
Esempi di geometria molecolare
Geometria molecolare di H2O
Atomo centrale della molecola = O
Numero di elettroni di valenza di O = 6
Numero di elettroni donati dagli atomi di idrogeno = 2 x (H)
= 2 x 1 = 2
Numero totale di elettroni intorno a N = 6 + 2 = 8
Numero di gruppi di elettroni = 8 / 2 = 4
Numero di coppie di elettroni solitari = 2
Numero di legami singoli presenti = 4 – 2 = 2
Quindi, geometria degli elettroni = Bent
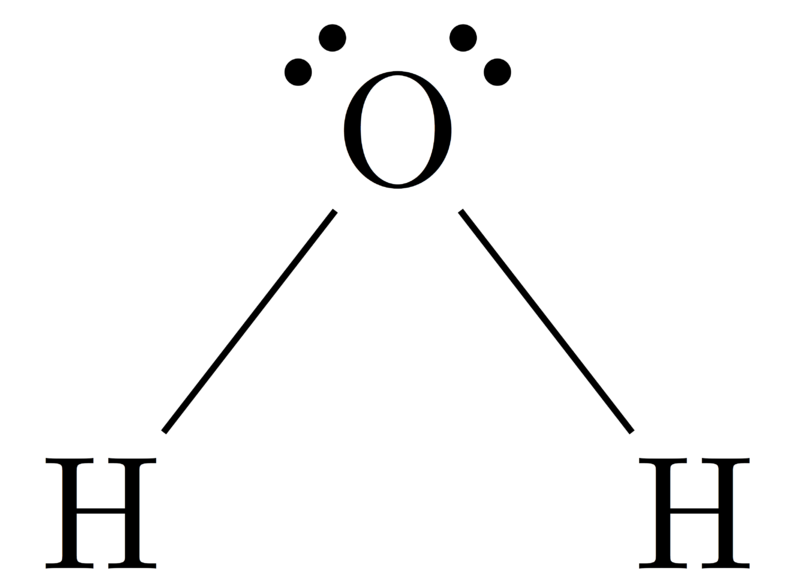
Figura 4: Geometria molecolare di H2O
Geometria molecolare dell’ammoniaca (NH3)
Atomo centrale della molecola = N
Numero di elettroni di valenza di N = 5
Numero di elettroni donati dagli atomi di idrogeno = 3 x (H)
= 3 x 1 = 3
Numero totale di elettroni intorno a N = 5 + 3 = 8
Numero di gruppi di elettroni = 8 / 2 = 4
Numero di coppie di elettroni solitari = 1
Numero di legami singoli presenti = 4 – 1 = 3
Quindi, geometria degli elettroni = piramide trigonale
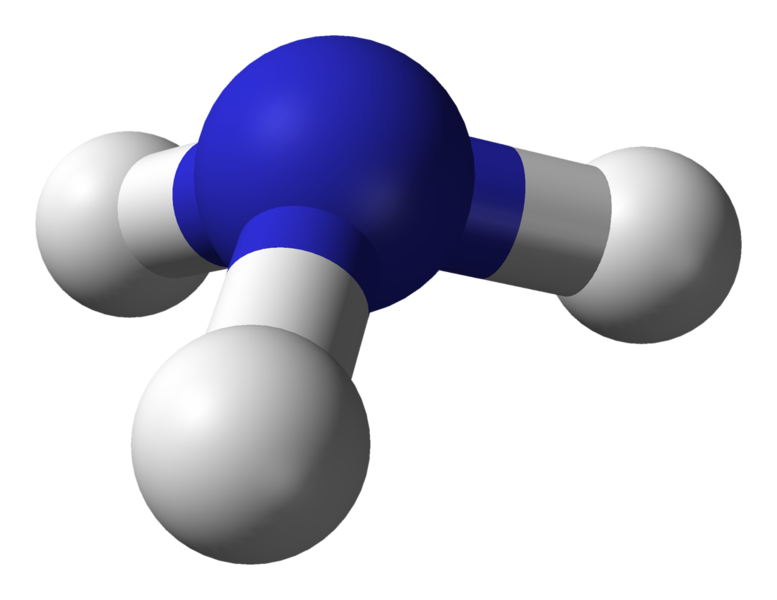
Figura 5: Struttura a sfera e bastone per la molecola di ammoniaca
La geometria degli elettroni dell’ammoniaca è tetraedrica. Ma la geometria molecolare dell’ammoniaca è a piramide trigonale.
Geometria delle molecole
La seguente tabella mostra alcune geometrie di molecole secondo il numero di coppie di elettroni presenti.
|
Numero di coppie di elettroni |
Numero di elettroni di legame |
Numero di coppie di elettroni solitari |
Geometria degli elettroni |
Geometria molecolare |
|
|
Lineare |
Lineare |
||||
|
Trigonale planare |
Planare trigonale |
||||
|
Planare trigonale |
Curva |
||||
|
Tetraedrico |
Tetraedrico |
||||
|
Tetraedrico |
Piramide trigonale |
||||
|
Tetraedrico |
Curvo |
||||
|
Trigonale bypiramidale |
Trigonale bypiramidale |
||||
|
Bipiramidale trigonale |
Seesaw |
||||
|
Bipiramidale trigonale |
T-a forma di |
||||
|
Trigonale bypiramidale |
Lineare |
||||
|
Ottaedrale |
Ottaedrico |
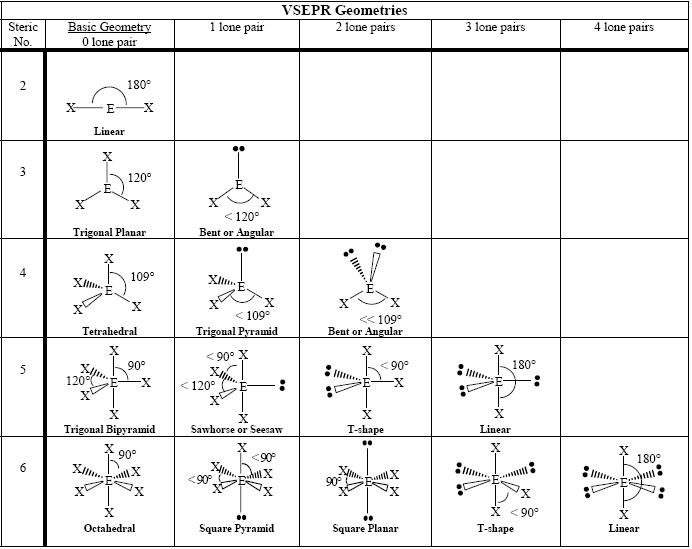
Figura 6: Geometrie di base delle molecole
La tabella precedente mostra le geometrie di base delle molecole. La prima colonna di geometrie mostra le geometrie degli elettroni. Le altre colonne mostrano le geometrie molecolari inclusa la prima colonna.
Differenza tra la geometria degli elettroni e la geometria molecolare
Definizione
Geometria degli elettroni: La geometria degli elettroni è la forma di una molecola prevista considerando sia le coppie di elettroni di legame che le coppie di elettroni solitari.
Geometria molecolare: La geometria molecolare è la forma di una molecola prevista considerando solo le coppie di elettroni di legame.
Coppie di elettroni solitari
Geometria dell’elettrone: Le coppie di elettroni solitari sono considerate quando si trova la geometria degli elettroni.
Geometria molecolare: Le coppie di elettroni solitari non sono considerate quando si trova la geometria molecolare.
Numero di coppie di elettroni
Geometria dell’elettrone: Il numero di coppie di elettroni totali dovrebbe essere calcolato per trovare la geometria degli elettroni.
Geometria molecolare: Il numero di coppie di elettroni di legame deve essere calcolato per trovare la geometria molecolare.
Conclusione
La geometria degli elettroni e la geometria molecolare sono le stesse quando non ci sono coppie di elettroni solitari sull’atomo centrale. Ma se ci sono coppie di elettroni solitari sull’atomo centrale, la geometria degli elettroni differisce sempre dalla geometria molecolare. Pertanto, la differenza tra la geometria elettronica e la geometria molecolare dipende dalle coppie di elettroni solitari presenti in una molecola.
1. “Geometria molecolare”. N.p., n.d. Web. Disponibile qui. 27 luglio 2017.
2. “Teoria VSEPR”. Wikipedia. Wikimedia Foundation, 24 luglio 2017. Web. Disponibile qui. 27 luglio 2017.
Immagine per gentile concessione:
1. “Metano-2D-piccolo” (Dominio Pubblico) via Commons Wikimedia
2. “Ammoniaca-2D-flat” Di Benjah-bmm27 – Opera propria (Dominio Pubblico) via Commons Wikimedia
3. “AlCl3” Di Dailly Anthony – Opera propria (CC BY-SA 3.0) via Commons Wikimedia
4. “H2O Lewis Structure PNG” Di Daviewales – Opera propria (CC BY-SA 4.0) via Commons Wikimedia
5. “Ammoniaca-3D-balls-A” Di Ben Mills – Opera propria (Pubblico Dominio) via Commons Wikimedia
6. “Geometrie VSEPR” Di Dr. Regina Frey, Washington University in St. Louis – Opera propria, Pubblico Dominio) via Commons Wikimedia
![]()