1. Morfología
2. Funciones
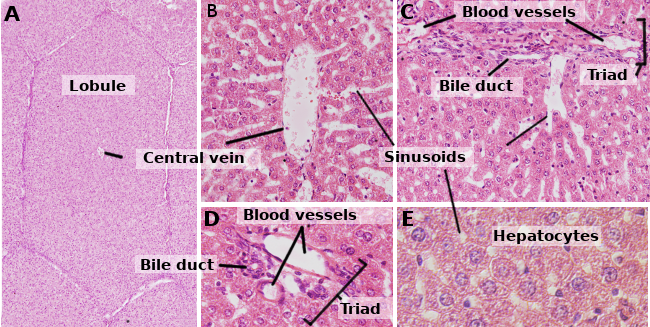
Los hepatocitos son las células del hígado, que representan aproximadamente el 80 % de este órgano. Se organizan en láminas de aproximadamente una célula de grosor. Las láminas están conectadas entre sí formando una estructura esponjosa (figuras 1 y 2). Los hepatocitos son células bastante longevas, renovándose aproximadamente cada 5 meses. Sin embargo, puede cambiar en procesos regenerativos donde los hepatocitos muestran una alta capacidad de proliferación y regeneración del tejido hepático dañado.

Morfología
Los hepatocitos son células poliedrales, es decir, tienen varias caras. Normalmente presentan 6 caras, pero el número puede variar. Las caras están en contacto con otro hepatocito o con un sinusoide (Figura 3). Los hepatocitos son células grandes, de unos 20 a 30 µm de diámetro. Presentan un núcleo redondo centrado en el citoplasma. Sin embargo, en el hígado de los humanos adultos, hasta el 25 % de los hepatocitos pueden ser binucleados (Figura 2). La mayoría de los núcleos son tetraploides, por lo que contienen el doble de ADN que una célula ordinaria. El tamaño de los núcleos es variable, aunque son más grandes en las células tetraploides. Los núcleos presentan heterocromatina dispersa y uno o más nucléolos. No es frecuente observar hepatocitos mitóticos (1 cada 10000 o 20000 hepatocitos) en condiciones normales. Sin embargo, los hepatocitos mitóticos aumentan enormemente bajo lesiones hepáticas y procesos de regeneración. Las características del citoplasma varían según el estado fisiológico de la célula, influenciado principalmente por los depósitos de grasa y glucógeno. Hay muchas mitocondrias pequeñas, de 800 a 100 por hepatocito. Se estima que un hepatocito puede contener unos 50 aparatos de Golgi que suelen estar organizados en pilas de 3 a 5 cisternas que muestran regiones laterales engrosadas que contienen cuerpos oscuros. Los apilamientos de cisternas están en cierto modo dispersos en el citoplasma, aunque a menudo se observan cerca de los canalículos billiarios (Figuras 3 y 4). Los hepatocitos contienen muchos peroxisomas (200 a 300), más que otras células regulares. Cerca de los canalículos billares, también se encuentran muchos lisosomas.


En el citoplasma de los hepatocitos se encuentran abundantes depósitos de glucógeno y lípidos (el aspecto granular de los hepatocitos tras la tinción con hematoxilina y eosina se debe a los huecos dejados por la extracción de lípidos del citoplasma durante el procesamiento del tejido). En el citoplasma también hay cuerpos residuales que contienen lipofuscina. El retículo endoplásmico liso es bastante abundante, aunque el tamaño del orgánulo varía con la actividad metabólica del hepatocito. Se concentra alrededor de los depósitos de glucógeno. En los lóbulos del hígado, hay diferencias morfológicas al comparar los hepatocitos periféricos y centrales, sobre todo influidas por las características de la sangre. Por ejemplo, después de la digestión, los hepatocitos periféricos son los primeros en almacenar glucógeno, pero los últimos en movilizar este glucógeno cuando el resto del cuerpo lo demanda. Sin embargo, el almacenamiento de grasa se produce primero en los hepatocitos situados en el centro, que suelen tener un retículo endoplásmico más liso. Por otro lado, el retículo endoplásmico rugoso muestra un 50 % más de superficie en los hepatocitos de localización periférica y media que en los de la parte interna del lóbulo hepático.
A diferencia de otras células epiteliales, los hepatocitos no están unidos a una membrana basal. Sus membranas basolaterales están rodeadas por una matriz extracelular de baja densidad sintetizada por los propios hepatocitos. Ésta facilita la difusión y el intercambio de moléculas con los sinusoides a través del espacio de Disse, o espacios perisinousoidales, que es el espacio entre el endotelio fenestrado y los hepatocitos. Esta matriz extracelular carece de laminina, al menos cuando el hepatocito está diferenciado. Sin embargo, el colágeno tipo IV y la fibronectina parecen necesarios para una correcta diferenciación del hepatocito. Los hepatocitos están conectados entre sí por medio de uniones gap, uniones adherentes, desmosomas y uniones estrechas.
Los hepatocitos son células polarizadas, es decir, existen diferencias entre las regiones orientadas hacia los canalículos biliares y las regiones cercanas a los sinusoides. La polaridad es esencial para el correcto funcionamiento del hepatocito, y está desorganizada en muchas patologías hepáticas. La región apical está en contacto con los canalículos biliares. Al igual que en el dominio apical de las células epiteliales, existen uniones estrechas, que sellan y mantienen la integridad de los canalículos biliares. La membrana apical se pliega en microvellosidades que aumentan enormemente la superficie de la membrana. La membrana apical es aproximadamente el 13% de la membrana total del hepatocito, y es capaz de contener una gran cantidad de moléculas. La eliminación de las uniones estrechas conduce a la desorganización de la polaridad celular. La polaridad de los hepatocitos y los canalículos biliares se establecen durante el periodo de desarrollo del embrión.
La polaridad funcional se basa en una distribución desigual de transportadores y otras moléculas de membrana entre los dominios de la membrana plasmática apical y basolateral. Los transportadores ABC (casetes de unión a ATP) se encuentran entre los transportadores apicales más importantes en los hepatocitos. El aparato de Golgi, los endosomas y el citoesqueleto (microtúbulos y filamentos de actina) son responsables de la distribución diferencial de las moléculas entre los dos dominios de la membrana. Existen dos vías de entrega de proteínas al dominio apical (Figura 5): desde el aparato de Golgi, las proteínas (por ejemplo, los transportadores ABC) se liberan en vesículas hacia la membrana plasmática apical o hacia los endosomas de reciclaje, que funcionan como intermediarios. Otras proteínas siguen una vía de transcitosis, viajando primero a las membranas basolaterales y luego se encierran en vesículas de endocitosis hacia los endosomas, donde se empaquetan de nuevo en vesículas y se envían a la membrana apical. Más rara es la vía que implica la exocitosis de los lisosomas, seguida de transportadores de cooper.

Funciones
La función principal de los hepatocitos es metabolizar las sustancias procedentes de la digestión. El hígado está irrigado por la vena porta que recogió las moléculas resultantes de la digestión en el intestino. Los hepatocitos también están muy implicados en la desintoxicación de moléculas potencialmente dañinas. Por otra parte, los hepatocitos sintetizan la bilis, que finalmente se libera en el intestino y ayuda a la digestión. Para ambas funciones, metabolizar las moléculas procedentes de la digestión y liberar la bilis, los hepatocitos se sitúan en un lugar privilegiado: en contacto con los sinusoides, que llevan al intestino las moléculas digeridas, y forman los canalículos biliares que drenan la bilis de los lóbulos del hígado.
Niveles de glucosa. Los hepatocitos recogen las moléculas de glucosa procedentes de la digestión y las almacenan como glucógeno, que se moviliza cuando el cuerpo necesita energía. El glucógeno suele encontrarse cerca del retículo endoplásmico, ya que la enzima glucosa-6-fosfatasa se encuentra en este orgánulo. La glucosa-6-fosfatasa cataliza la glucosa-6-fosfato, la forma molecular de la glucosa tras el catabolismo del glucógeno, y produce glucosa libre, que puede salir del hepatocito y llegar al torrente sanguíneo.
Síntesis de moléculas. Las sales biliares, que ayudan a la digestión de las grasas, son una de las sustancias sintetizadas por los hepatocitos. En el retículo endoplásmico liso hay muchas enzimas que participan en la síntesis del colesterol y otros lípidos. Además, los hepatocitos producen las lipoproteínas necesarias para el transporte de los lípidos en el torrente sanguíneo. El fibrinógeno para la coagulación de la sangre y las albúminas plasmáticas también son sintetizadas por los hepatocitos. En el hígado se produce urea como subproducto de la degradación de las proteínas. La producción y acumulación de una cantidad elevada de urea en el organismo puede ser perjudicial. Los hepatocitos almacenan vitamina A y B, y heparina.
Metabolismo lipídico. La beta-oxidación, implicada en el catabolismo de los lípidos, funciona en los abundantes peroxisomas de los hepatocitos.
Detoxificación. Los hepatocitos recogen las sustancias nutritivas procedentes de la digestión, pero también son los primeros en recibir las sustancias potencialmente tóxicas. El etanol de las bebidas alcohólicas se degrada principalmente en el hígado, en realidad en los numerosos peroxisomas de los hepatocitos. La mitad del alcohol ingerido se transforma en acetaldehído en estos orgánulos. En el retículo endoplásmico liso hay enzimas que participan en la degradación o inactivación de toxinas y fármacos. Durante los periodos de alta demanda de eliminación de sustancias tóxicas, como durante los tratamientos con medicamentos o el consumo continuado de alcohol, el retículo endoplásmico puede convertirse en el orgánulo más voluminoso del hepatocito. Los fármacos suelen inactivarse mediante la conjugación con otras moléculas. Por ejemplo, la glucosiltransferasa conjuga las moléculas con los barbitúricos.
Almacenamiento y regulación del hierro. Los hepatocitos pueden trabajar para almacenar el hierro, que se concentra en depósitos citoplasmáticos unidos a la ferritina. Los hepatocitos pueden captar el hierro de varias maneras: unido a la transferrina, como parte de grupos hemo y de grupos no hemo. La transferrina-hierro entra en la célula por endocitosis mediada por el receptor TRF1. Cuando las vesículas endocíticas se fusionan con los endosomas, la transferrina libera Fe3+, que se transforma en F2+ y es extruido al citosol por el transportador DMT1 (divalent metal transporter 1). Las moléculas de hemo-hierro también son endocitadas y son translocadas al citosol a través de la membrana endosomal por el transportador HRG1. Sin embargo, la mayor parte del hierro entra desde el espacio extracelular a través del transportador ZIP14 situado en la membrana plasmática del hepatocito frente a los sinusoides. Una vez en el citosol, el hierro se une a la ferritina y se almacena en el citoplasma porque el hierro libre es tóxico. La liberación del hierro del enterocito está mediada por el transportador de ferroportina que se encuentra en la membrana plasmática cerca de los sinusoides.
Después de la médula ósea, el hígado es el segundo centro principal de producción de grupos hemo. El grupo hemo es un grupo prostético (no peptídico) presente en varias proteínas para el transporte de oxígeno, en aquellas enzimas como las catalasas y las peroxidasas que protegen contra las sustancias oxidantes. También forma parte de los citocromos mitocondriales y peroxisomales. La mayor cantidad de grupos hemo se encuentra en la hemoglobina, que se sintetiza en la médula ósea. En el hígado, la síntesis de los grupos hemo depende de la cantidad de citocromos p450 microsomales que necesita la célula, por lo que la mayoría de estos grupos hemo forman parte de los citocromos p450.
Los hepatocitos liberan la hormona hepcidina, que regula la concentración sistémica de hierro en el organismo. Esta hormona controla la cantidad de hierro en el plasma favoreciendo la internalización y degradación de la ferroportina, transportador de hierro que se encuentra en los enterocitos, macrófagos y hapatocitos. La eliminación de la ferroportina inhibe la liberación de hierro de estas células. La síntesis de hepcidina está regulada por la concentración de hierro-transferrina en el plasma, por los depósitos de hierro en los hepatocitos y por la inflamación. La actividad eritropoyética inhibe la liberación de hepcidina.
Bibliografía
Gissen P, Arias IM. 2015. Polaridad estructural y funcional del hepatocito y enfermedad hepática. Journal of hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Células madre intestinales adultas: conductores críticos de la homeostasis epitelial y la regeneración. Nature review in molecular cell biology. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelona.