Diferencia principal – Geometría Electrónica vs Geometría Molecular
La geometría de una molécula determina la reactividad, la polaridad y la actividad biológica de esa molécula. La geometría de una molécula puede darse como geometría electrónica o como geometría molecular. La teoría VSEPR (Valence Shell Electron Pair Repulsion theory) puede utilizarse para determinar las geometrías de las moléculas. La geometría electrónica incluye los pares de electrones solitarios presentes en una molécula. La geometría molecular puede determinarse por el número de enlaces que tiene una molécula concreta. La principal diferencia entre la geometría de los electrones y la geometría molecular es que la geometría de los electrones se encuentra tomando tanto los pares de electrones solitarios como los enlaces en una molécula, mientras que la geometría molecular se encuentra utilizando sólo los enlaces presentes en la molécula.
Aspectos clave que se tratan
1. Qué es la Geometría de los Electrones
– Definición, Identificación, Ejemplos
2. Qué es la Geometría Molecular
– Definición, Identificación, Ejemplos
3. Qué son las Geometrías de las Moléculas
– Cuadro explicativo
4. Qué diferencia hay entre la Geometría de los Electrones y la Geometría Molecular
– Comparación de las diferencias clave
Términos clave: Geometría de los electrones, par de electrones solitario, geometría molecular, Teoría VSEPR

Qué es la geometría de los electrones
La geometría de los electrones es la forma de una molécula que se predice considerando tanto los pares de electrones de enlace como los pares de electrones solitarios. La teoría VSEPR establece que los pares de electrones situados alrededor de un determinado átomo se repelen entre sí. Estos pares de electrones pueden ser electrones enlazantes o electrones no enlazantes.
La geometría de los electrones da la disposición espacial de todos los enlaces y pares de electrones solitarios de una molécula. La geometría de los electrones se puede obtener utilizando la teoría VSEPR.
Cómo determinar la geometría de los electrones
Los siguientes son los pasos utilizados en esta determinación.
- Predecir el átomo central de la molécula. Debe ser el átomo más electronegativo.
- Determinar el número de electrones de valencia del átomo central.
- Determinar el número de electrones donados por otros átomos.
- Calcular el número total de electrones alrededor del átomo central.
- Dividir ese número entre 2. Esto da el número de grupos de electrones presentes.
- Deducir el número de enlaces simples presentes alrededor del átomo central del número estérico obtenido anteriormente. Esto da el número de pares de electrones solitarios presentes en la molécula.
- Determine la geometría de los electrones.
Ejemplos
Geometría electrónica del CH4
Atomo central de la molécula = C
Número de electrones de valencia del C = 4
Número de electrones donados por los átomos de hidrógeno = 4 x (H)
= 4 x 1 = 4
Número total de electrones alrededor del C = 4 + 4 = 8
Número de grupos de electrones = 8 / 2 = 4
Número de enlaces simples presentes = 4
Número de pares de electrones solitarios = 4 – 4 = 0
Por lo tanto, la geometría del electrón = tetraédrica
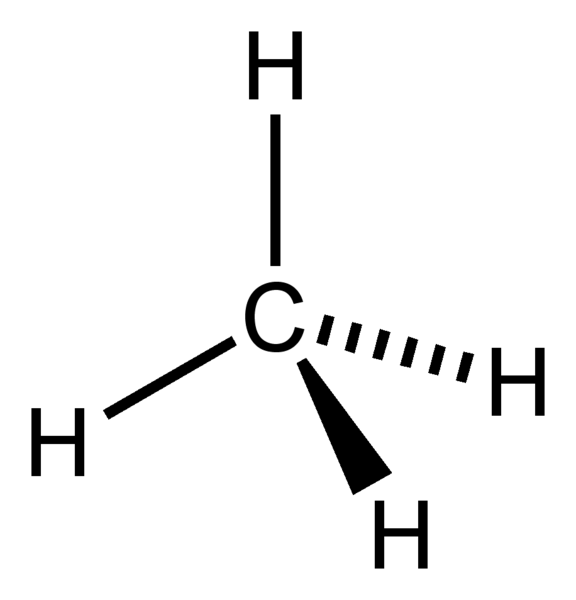
Figura 1: Geometría electrónica del CH4
Geometría electrónica del amoníaco (NH3)
Atomo central de la molécula = N
Número de electrones de valencia del N = 5
Número de electrones donados por los átomos de hidrógeno = 3 x (H)
= 3 x 1 = 3
Número total de electrones alrededor de N = 5 + 3 = 8
Número de grupos de electrones = 8 / 2 = 4
Número de enlaces simples presentes = 3
Número de pares de electrones solitarios = 4 – 3 = 1
Por lo tanto, la geometría del electrón = tetraédrica
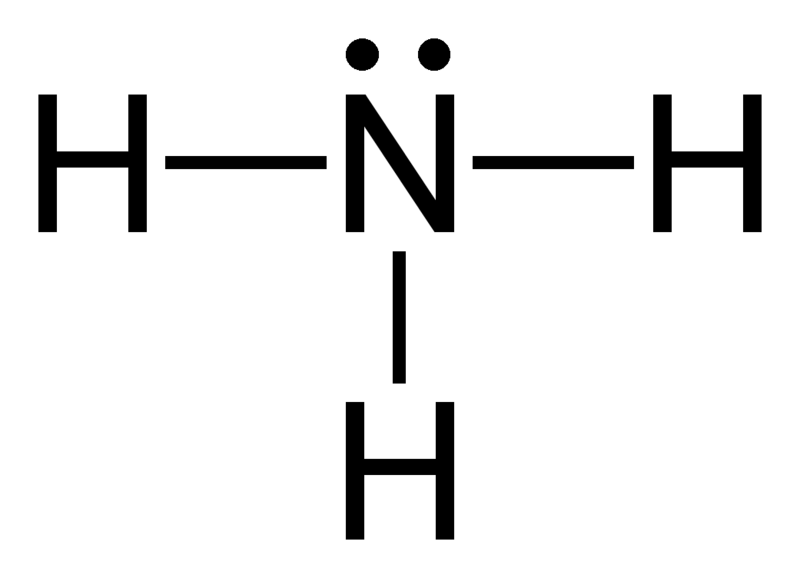
Figura 2: Geometría electrónica del amoníaco
Geometría electrónica del AlCl3
Atomo central de la molécula = Al
Número de electrones de valencia del Al = 3
Número de electrones donados por los átomos de Cl = 3 x (Cl)
= 3 x 1 = 3
Número total de electrones alrededor de N = 3 + 3 = 6
Número de grupos de electrones = 6 / 2 = 3
Número de enlaces simples presentes = 3
Número de pares de electrones solitarios = 3 – 3 = 0
Por lo tanto, la geometría de los electrones = trigonal plana

Figura 3: Geometría electrónica de AlCl3
A veces, la geometría electrónica y la geometría molecular son iguales. Esto se debe a que sólo se consideran los electrones de enlace en la determinación de la geometría en ausencia de pares de electrones solitarios.
Qué es la geometría molecular
La geometría molecular es la forma de una molécula que se predice considerando sólo los pares de electrones de enlace. En este caso, los pares de electrones solitarios no se tienen en cuenta. Además, los dobles enlaces y los triples enlaces se consideran como enlaces simples. Las geometrías se determinan basándose en el hecho de que los pares de electrones solitarios necesitan más espacio que los pares de electrones de enlace. Por ejemplo, si una determinada molécula está compuesta por dos pares de electrones de enlace junto con un par solitario, la geometría molecular no es lineal. La geometría allí es «doblada o angular» porque el par de electrones solitarios necesita más espacio que dos pares de electrones enlazantes.
Ejemplos de geometría molecular
Geometría molecular del H2O
Atomo central de la molécula = O
Número de electrones de valencia del O = 6
Número de electrones donados por los átomos de hidrógeno = 2 x (H)
= 2 x 1 = 2
Número total de electrones alrededor de N = 6 + 2 = 8
Número de grupos de electrones = 8 / 2 = 4
Número de pares de electrones solitarios = 2
Número de enlaces simples presentes = 4 – 2 = 2
Por tanto, geometría de los electrones = Bent
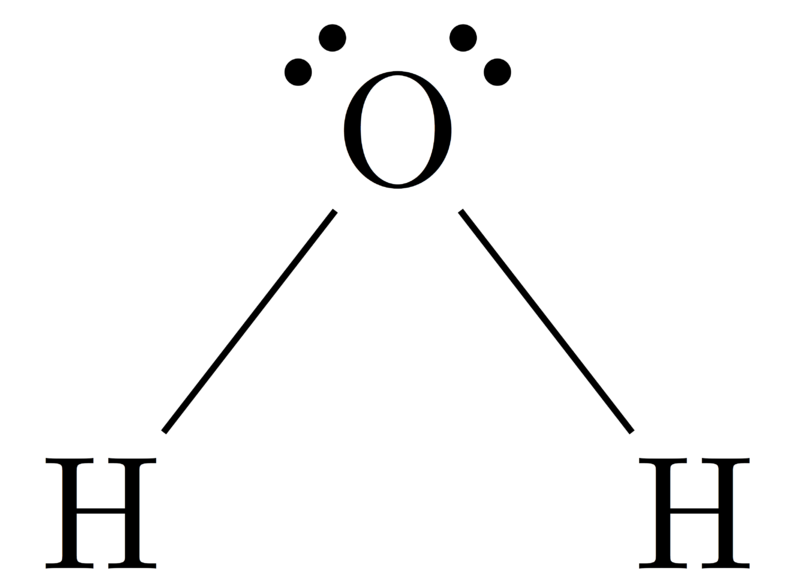
Figura 4: Geometría molecular del H2O
Geometría molecular del amoníaco (NH3)
Atomo central de la molécula = N
Número de electrones de valencia del N = 5
Número de electrones donados por los átomos de hidrógeno = 3 x (H)
= 3 x 1 = 3
Número total de electrones alrededor de N = 5 + 3 = 8
Número de grupos de electrones = 8 / 2 = 4
Número de pares de electrones solitarios = 1
Número de enlaces simples presentes = 4 – 1 = 3
Por tanto, geometría de los electrones = pirámide trigonal
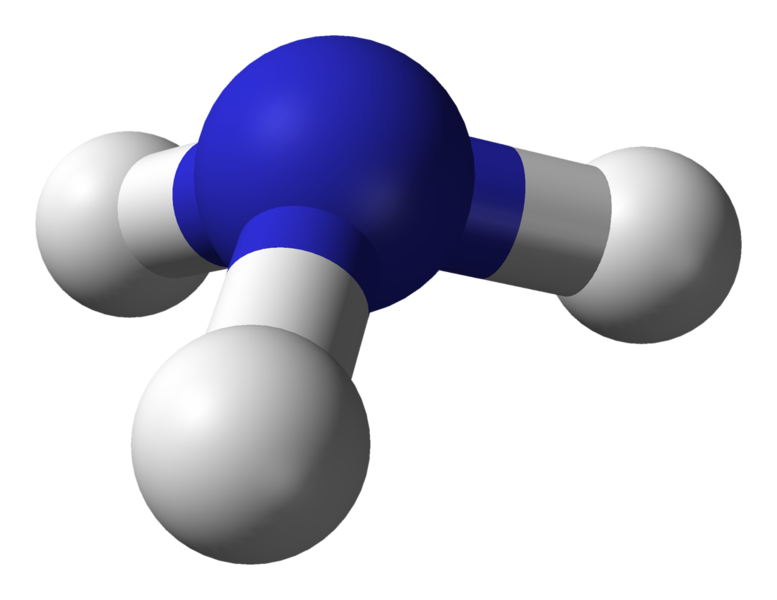
Figura 5: Estructura de bola y palo para la molécula de amoníaco
La geometría electrónica del amoníaco es tetraédrica. Pero la geometría molecular del amoníaco es de pirámide trigonal.
Geometría de las moléculas
La siguiente tabla muestra algunas geometrías de las moléculas según el número de pares de electrones presentes.
|
Número de pares de electrones |
Número de pares de electrones de enlace pares de electrones |
Número de pares de electrones solitarios |
Geometría de los electrones |
Geometría molecular |
Lineal |
||||||||||||||
|
Trigonal planar |
Planarrigonal |
||||||||||||||||||
|
Planarrigonal |
Doblado |
Tetraédrica |
|||||||||||||||||
|
Pirámide trigonal |
|||||||||||||||||||
|
Tetraédrica |
Doblada |
||||||||||||||||||
|
Bipiramidalrigonal |
Bipiramidal Trigonal |
Sierra |
Se trata de unashaped |
||||||||||||||||
|
Octaédrica |
Se trata de una forma de T. |
Octaédrica |
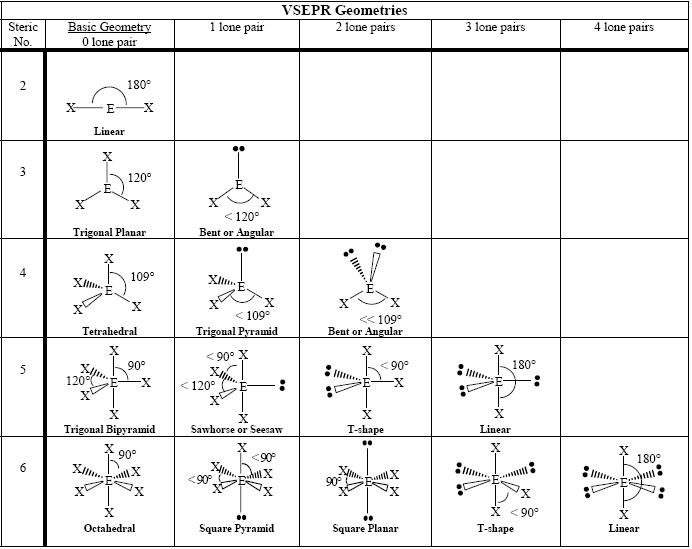
Figura 6: Geometrías básicas de las moléculas
La tabla anterior muestra las geometrías básicas de las moléculas. La primera columna de geometrías muestra las geometrías de los electrones. Otras columnas muestran geometrías moleculares incluyendo la primera columna.
Diferencia entre geometría de electrones y geometría molecular
Definición
Geometría de electrones: La geometría de los electrones es la forma de una molécula que se predice considerando tanto los pares de electrones de enlace como los pares de electrones solitarios.
Geometría molecular: La geometría molecular es la forma de una molécula que se predice considerando sólo los pares de electrones de enlace.
Pares de electrones solitarios
Geometría de electrones: Los pares de electrones solitarios se consideran al encontrar la geometría de los electrones.
Geometría molecular: Los pares de electrones solitarios no se consideran al encontrar la geometría molecular.
Número de pares de electrones
Geometría de electrones: El número de pares de electrones totales debe calcularse para encontrar la geometría electrónica.
Geometría molecular: El número de pares de electrones de enlace debe ser calculado para encontrar la geometría molecular.
Conclusión
La geometría de los electrones y la geometría molecular son las mismas cuando no hay pares de electrones solitarios en el átomo central. Pero si hay pares de electrones solitarios en el átomo central, la geometría del electrón siempre difiere de la geometría molecular. Por lo tanto, la diferencia entre la geometría electrónica y la geometría molecular depende de los pares de electrones solitarios presentes en una molécula.
1. «Geometría molecular». N.p., n.d. Web. Disponible aquí. 27 de julio de 2017.
2. «Teoría VSEPR». Wikipedia. Fundación Wikimedia, 24 de julio de 2017. Web. Disponible aquí. 27 de julio de 2017.
Imagen cortesía:
1. «Metano-2D-pequeño» (Dominio Público) vía Commons Wikimedia
2. «Amoníaco-2D-plano» Por Benjah-bmm27 – Obra propia (Dominio Público) vía Commons Wikimedia
3. «AlCl3» Por Dailly Anthony – Obra propia (CC BY-SA 3.0) vía Commons Wikimedia
4. «H2O Lewis Structure PNG» Por Daviewales – Obra propia (CC BY-SA 4.0) vía Commons Wikimedia
5. «Ammonia-3D-balls-A» Por Ben Mills – Obra propia (Dominio Público) vía Commons Wikimedia
6. «VSEPR geometries» Por Dr. Regina Frey, Washington University in St. Louis – Obra propia, Dominio Público) vía Commons Wikimedia
![]()