US Pharm. 2010;35(9):41-48.
La enfermedad de Lyme, también conocida como borreliosis de Lyme, es la enfermedad transmitida por vectores más común en los Estados Unidos.1,2 La enfermedad se reconoció por primera vez en 1975 en una serie de niños de Lyme, Connecticut, a los que inicialmente se les diagnosticó artritis reumatoide juvenil debido a la coincidencia de signos y síntomas.1 En 1982, Willy Burgdorfer, PhD, descubrió que una espiroqueta aislada de Ixodes scapularis, una garrapata de ciervo, era la misma espiroqueta encontrada en pacientes con la enfermedad de Lyme.
Los casos confirmados de la enfermedad de Lyme se definen como eritema migratorio (EM) de más de 5 cm de diámetro o una o más manifestaciones tardías objetivas de la enfermedad de Lyme con confirmación de laboratorio en pacientes con posible exposición a garrapatas. En Healthy People 2010 se fijó el objetivo de reducir la incidencia de la enfermedad de Lyme en un 44% para 2010. Desde el año 2000, los CDC han aportado más de 3,5 millones de dólares al año para nuevas investigaciones sobre la enfermedad de Lyme.2
El ratón de patas blancas y el ciervo de cola blanca son los principales reservorios de la transmisión de la enfermedad de Lyme en Estados Unidos.2,3 los dos insectos vectores que portan el patógeno gramnegativo Borrelia burgdorferi son I scapularis (garrapata de patas negras o garrapata del ciervo) e Ixodes pacificus (garrapata occidental de patas negras).1 Los estados del noreste, del medio oeste y del Atlántico experimentan la transmisión del patógeno principalmente por la garrapata de patas negras, mientras que la garrapata occidental de patas negras es la causa de la infección en la costa del Pacífico (FIGURA 1).1,3
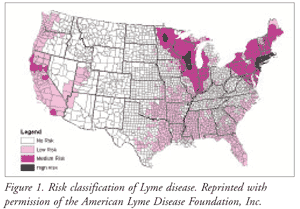
Las tasas de infección son más elevadas durante la primavera y principios del otoño, y la mayoría de los casos se producen de junio a agosto.1-3 La costa noreste, la costa del Pacífico y los estados del medio oeste (región de los Grandes Lagos) tienen las tasas más altas de infección en los Estados Unidos.2,3 Las infecciones predominan en zonas muy boscosas.
Patogénesis
Tanto la garrapata de patas negras como la garrapata del ciervo occidental tienen tres etapas de desarrollo que afectan a la tasa de transmisión del patógeno a los seres humanos (FIGURA 2).1,3 Después de salir del huevo, la larva (etapa 1) se engancha y se alimenta de la sangre del ratón de cola blanca (reservorio), que puede o no contener el patógeno B burgdorferi.1,3 A continuación (fase 2), a finales de la primavera, la larva alimentada se desprende del reservorio del ratón y se transforma en una ninfa latente. La primavera siguiente, comienza la actividad ninfal. La garrapata se adhiere a un nuevo huésped, posiblemente un humano. Esta fase es la responsable de la mayoría de los casos de la enfermedad de Lyme, ya que la garrapata ninfa, que tiene el tamaño de una semilla de amapola, suele pasar desapercibida hasta que está completamente llena de sangre.
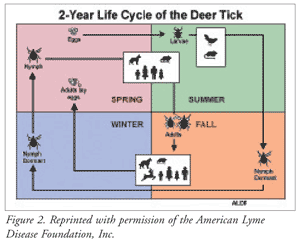
Una vez alimentada por completo, la garrapata se desprende en el follaje más alto para asegurar la adhesión a su huésped preferido, el ciervo, aunque cualquier mamífero (por ejemplo, humano, perro, caballo) puede ser el objetivo. En este momento, también se transforma en un adulto (estadio 3) y se vuelve significativamente más grande; ahora es más fácil de descubrir y es menos probable que propague la enfermedad. La transmisión de B burgdorferi puede producirse a las 24 horas de la adhesión, pero la mayoría de las transmisiones se producen después de 36 a 48 horas de alimentación constante por parte de la garrapata. Cuando empieza el invierno y hay menos huéspedes disponibles, el adulto permanece inactivo hasta la primavera, cuando busca otro huésped. Una vez que encuentra un huésped y el adulto se alimenta, se aparea y pone huevos, perpetuando el ciclo.
Prevención y profilaxis
Hay medidas que la gente puede tomar para prevenir la infección por borreliosis de Lyme.3 El mejor método es evitar las zonas infestadas de garrapatas. Otras medidas son revisar con frecuencia la piel y la ropa, llevar ropa de color claro que muestre fácilmente las garrapatas, usar ropa protectora (por ejemplo, camisa de manga larga metida dentro de los pantalones, pantalones largos metidos dentro de los calcetines), rociar la piel y la ropa con repelentes de garrapatas e insectos (que contengan N,N-dietil-3-metilbenzamida ) y retirar una garrapata adherida con una pinza de punta fina o fórceps.3 El DEET debe reaplicarse con frecuencia; aunque se han dado casos de síntomas neurológicos por el uso excesivo en niños, la Sociedad de Enfermedades Infecciosas de América (IDSA) recomienda su uso en niños a partir de 2 meses si se utiliza según las indicaciones.3 Un aerosol de permetrina disponible para la ropa mata a las garrapatas al entrar en contacto con ellas; no debe usarse en la piel debido a la inactivación causada por los aceites de la piel.3 El fabricante (SmithKline Beecham Pharmaceuticals) dejó de fabricar una vacuna disponible anteriormente (LYMErix) en 2002 debido a las bajas ventas.4 En la actualidad, no se dispone de ninguna vacuna contra la enfermedad de Lyme.
Los estudios indican que la transmisión de B burgdorferi requiere al menos 36 horas de fijación.5 Después de una picadura de garrapata reconocida, no se recomienda la profilaxis rutinaria con una dosis única de doxiciclina 200 mg a menos que se cumplan las cuatro condiciones siguientes: «a) la garrapata adherida puede identificarse de forma fiable como una garrapata adulta o ninfal de I. scapularis que se estima que ha estado adherida durante ≥36 h sobre la base del grado de congestión de la garrapata con sangre o de la certeza sobre el momento de la exposición a la garrapata; b) la profilaxis puede iniciarse dentro de las 72 h siguientes al momento en que se retiró la garrapata; c) la información ecológica indica que la tasa local de infección de estas garrapatas con B. burgdorferi es ≥20%; y (d) el tratamiento con doxiciclina no está contraindicado».3 La profilaxis tras una picadura de garrapata I pacificus no suele ser necesaria porque la tasa de infección es baja.3
Presentación y tratamiento
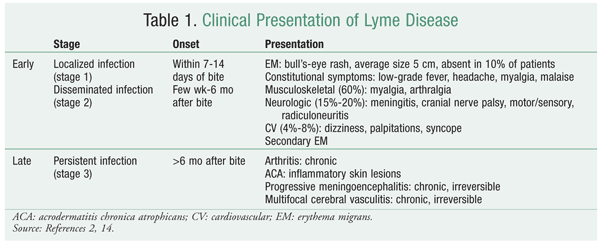
La enfermedad de Lyme tiene tres estadios: localizado temprano, diseminado temprano y persistente tardío (TABLA 1).2 El estadio en el que se presenta el paciente determina la elección del antibiótico y la duración del tratamiento. La enfermedad localizada temprana suele comenzar con la clásica lesión en forma de ojo de buey, el eritema migratorio, en el lugar de la picadura. Esta lesión cutánea característica se considera el signo diagnóstico más fuerte de la enfermedad de Lyme, que se manifiesta en el 90% de los casos y suele aparecer en el plazo de un mes desde la picadura. La enfermedad temprana puede caracterizarse por la afectación cardiaca y neurológica. Los datos de laboratorio no suelen utilizarse debido a la lenta multiplicación del organismo cultivado, la baja sensibilidad de la reacción en cadena de la polimerasa y la confusión de las infecciones pasadas frente a las activas en las pruebas serológicas.6 El patógeno se disemina con el tiempo; un paciente puede presentar múltiples lesiones y los síntomas constitucionales pueden ser más pronunciados. En la enfermedad de Lyme persistente tardía, el patógeno se ha infiltrado más en varios sistemas orgánicos; en particular, causa artritis en las articulaciones grandes, sobre todo en la rodilla.
Los antimicrobianos son una terapia eficaz para la enfermedad de Lyme. La IDSA ha desarrollado directrices basadas en la evidencia para ayudar en el manejo de la borreliosis de Lyme. Múltiples estudios han demostrado que B burgdorferi es sensible a las tetraciclinas, las penicilinas y las cefalosporinas de segunda y tercera generación.7,8 No se recomienda el uso de macrólidos como terapia de primera línea, ya que los ensayos clínicos han demostrado que son menos eficaces que otros antibióticos.9-11 La terapia con macrólidos debe reservarse para los pacientes que no toleran o no pueden tomar ninguno de los antibióticos mencionados. Las cefalosporinas de primera generación no deben usarse nunca para tratar la enfermedad de Lyme.
Durante la fase localizada temprana, que implica la ME, los adultos y los niños pueden ser tratados con doxiciclina, amoxicilina o cefuroxima axetil. La doxiciclina no debe administrarse a mujeres embarazadas o en periodo de lactancia, ni a niños menores de 8 años, debido a efectos adversos como el aumento del riesgo de teratogenicidad en las primeras y la decoloración de los dientes en los segundos. En ausencia de estas contraindicaciones, la doxiciclina es el fármaco de elección porque también es activa frente a organismos co-infecciosos comunes como el Anaplasma phagocytophilum, causante de la anaplasmosis granulocítica humana, y tiene una penetración bastante buena en el sistema nervioso central, cosa que no hacen los otros agentes. Dado que la ME puede tener un aspecto similar al de la celulitis adquirida en la comunidad, es mejor utilizar antibióticos -como cefuroxima axetil y amoxicilina/ácido clavulánico- que puedan cubrir ambos tipos de infección cuando sea difícil hacer la distinción.12 Ver TABLA 2.
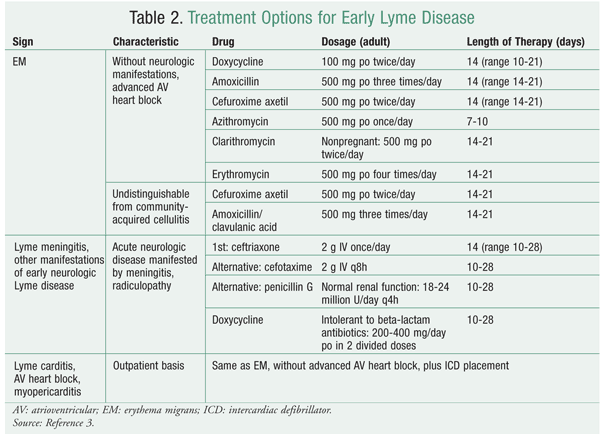
Cuando se presentan manifestaciones neurológicas como meningitis o radiculopatía, puede utilizarse ceftriaxona IV. Las alternativas a la ceftriaxona incluyen la cefuroxima IV y la penicilina G. Si el paciente es alérgico a los antibióticos betalactámicos, puede utilizarse la doxiciclina como sustituto.3 Véase la TABLA 2.
Los pacientes con bloqueo cardíaco atrioventricular y/o miopericarditis durante la enfermedad de Lyme temprana suelen ser tratados durante una media de 14 días. Los adultos y niños hospitalizados deben recibir ceftriaxona IV como recomendación inicial, en el mismo régimen que para la meningitis de Lyme. Un paciente que presente un bloqueo cardíaco auriculoventricular avanzado puede recibir un marcapasos temporal por consejo de un cardiólogo. Para los pacientes externos, el régimen es el mismo que para la ME sin carditis.3
La enfermedad de Lyme en fase avanzada implica una infección que persiste meses o años después de la infección inicial. Los síntomas incluyen artritis, enfermedad neurológica y acrodermatitis crónica atrofiada (ACA; una condición dermatológica que conduce a la atrofia de la piel).13 El tratamiento, según las directrices de la IDSA, es similar al de la enfermedad de Lyme temprana, con la diferencia de que la duración de la terapia es más larga para la enfermedad en etapa tardía. Las manifestaciones de artritis y ACA se tratan con doxiciclina, amoxicilina o cefuroxime axetil, como en el caso de la EM temprana.3 La duración del tratamiento es de 28 días para la artritis y 21 días para la ACA, mientras que la duración media de la EM es de 14 días.3 La terapia para la enfermedad neurológica en fase tardía consiste en ceftriaxona, cefotaxima o penicilina G durante 14 a 28 días, lo que es similar al tratamiento para la meningitis, que puede ocurrir durante la enfermedad de Lyme en fase temprana.3
Efectos adversos
Doxiciclina: Algunas alteraciones gastrointestinales (GI) comunes son disfagia, anorexia, diarrea, colitis pseudomembranosa y vómitos.14 Las manifestaciones dermatológicas pueden incluir fotosensibilidad, erupción cutánea e hiperpigmentación de la piel. Algunos acontecimientos adversos poco frecuentes son la ulceración esofágica, la esofagitis, la dermatitis exfoliativa y la hepatotoxicidad. Debido a que la doxiciclina puede causar daño fetal (categoría D de embarazo), es preferible no utilizarla durante el embarazo.
Amoxicilina, ácido clavulánico, penicilina G: Las náuseas, los vómitos, la diarrea y la colitis pseudomembranosa son efectos secundarios GI comunes.14 Puede desarrollarse una erupción cutánea, incluyendo tipos potencialmente mortales como el síndrome de Stevens-Johnson (SJS) y la necrólisis epidérmica tóxica (TEN), que debe ser comunicada a un médico inmediatamente.
Cefuroxima Axetil: Pueden producirse alteraciones gastrointestinales como náuseas, vómitos y diarrea.14 Otros efectos adversos más infrecuentes son colitis pseudomembranosa, SJS, TEN y calambres de estómago.
Ceftriaxona: Dado que la ceftriaxona es un medicamento parenteral que puede administrarse por vía intravenosa en el contexto de la enfermedad de Lyme, pueden producirse dolor y sensibilidad en el lugar de la inyección.14 También pueden producirse erupciones y diarrea. Los acontecimientos adversos más raros son similares a los de la cefuroxima axetil: colitis pseudomembranosa, síndrome de jalea sistémica y RTE.
Macrólidos (azitromicina, claritromicina, eritromicina): Pueden producirse náuseas, vómitos, diarrea y erupción cutánea.14 En raras ocasiones, un paciente puede presentar SJS, TEN, pérdida de audición o colitis pseudomembranosa, o puede experimentar arritmias debido a la prolongación del QTc. La azitromicina y la eritromicina son de categoría B para el embarazo; la claritromicina es de categoría C porque algunos estudios han documentado efectos fetales adversos. Como resultado, las directrices de la ISDA recomiendan el uso de claritromicina sólo en pacientes no embarazadas.3
Duración de la terapia
La elección del agente antimicrobiano para el tratamiento de la enfermedad de Lyme ha sido bien estudiada, pero la duración del tratamiento sigue siendo objeto de escrutinio.3,15 Las directrices actuales de la IDSA recomiendan de 10 a 14 días para la enfermedad de Lyme temprana. Un reciente estudio retrospectivo encontró que los resultados eran similares en los pacientes que recibían menos de 10 días de terapia frente a los que recibían una terapia más prolongada.15 Esto apoya estudios anteriores, que concluyeron que el tratamiento durante 10 días era tan eficaz como los regímenes de tratamiento más largos. Otro punto de interés de este estudio reciente son los datos relativos a la prescripción excesiva por parte de los médicos. En la institución de los investigadores, menos del 16% de los pacientes recibió menos de 10 días de terapia, mientras que el 44% recibió más de 16 días. A menudo, el tratamiento adicional conlleva más efectos adversos. Por lo tanto, si los pacientes siguen teniendo síntomas constitucionales, deben ser reevaluados por otras afecciones que se comentan en la siguiente sección.
Monitoreo de la respuesta
El fracaso del tratamiento es raro y con frecuencia se etiqueta erróneamente por una serie de razones.3,16 La mayoría de los pacientes se recuperan por completo después de tomar los antibióticos adecuados, pero un pequeño número de pacientes sigue experimentando síntomas constitucionales como dolor de cabeza, fatiga y dolores musculares. Aunque este estado se denomina síndrome postenfermedad de Lyme o enfermedad de Lyme crónica, no está causado por la infección persistente por B burgdorferi, ni se comprende del todo. Hasta la fecha, no se han registrado casos de B burgdorferi resistente.
Cuando un paciente sigue quejándose de los síntomas después de haber completado un curso de antibióticos adecuados, deben investigarse varios factores. El paciente puede no haber cumplido con la terapia; el diagnóstico inicial de la enfermedad de Lyme puede haber sido incorrecto; puede haberse producido una reinfección con una nueva garrapata o una coinfección con otro organismo transmitido por garrapatas; o puede haber otra afección, como la fibromialgia o el síndrome de fatiga crónica. Aunque no hay ningún beneficio de los antibióticos adicionales después del tratamiento inicial, los prescriptores siguen re prescribiendo antibióticos sin una reevaluación exhaustiva. A medida que la investigación continúe, es probable que se extienda la concienciación sobre la ineficacia del retratamiento.
Conclusión
Es imprescindible conocer bien la enfermedad de Lyme, la enfermedad transmitida por garrapatas más común en los EE.UU. El número de casos notificados ha aumentado en un 101% desde 1996 (9.908 casos) hasta 2002 (19.931 casos).17 Y lo que es más alarmante, el número sigue aumentando, con 28.921 casos confirmados de la enfermedad de Lyme en 2008.18 Los pacientes deben ser educados sobre las medidas preventivas que pueden tomar cuando viajan a ciertas áreas, y deben ser aconsejados sobre medicamentos específicos para mejorar su cumplimiento y eliminar la infección. En abril de 2010, la IDSA reevaluó sus directrices de 2006 y mantuvo sus recomendaciones.
1. Bratton RL, Whiteside JW, Hovan MJ, et al. Diagnóstico y tratamiento de la enfermedad de Lyme. Mayo Clin Proc. 2008;83:566-571.
2. CDC. Learn about Enfermedad de Lyme.www.cdc.gov/ncidod/dvbid/lyme. Consultado el 17 de abril de 2010.
3. Wormser GP, Dattwyler RJ, Shapiro ED, et al. The clinical assessment, treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis. 2006;43:1089-1134.
4. National Institute of Allergy and Infectious Diseases. Lyme disease. Producción de vacunas.www.niaid.nih.gov/topics/lymedisease/research/pages/vaccine.aspx. Consultado el 28 de abril de 2010.
5. Steere AC, Klitz W, Drouin EE, et al. La artritis de Lyme refractaria a los antibióticos está asociada a las moléculas HLA-DR que se unen a un péptido de Borrelia burgdorferi. J Exp Med. 2006;203:961-971.
6. Marques AR. Enfermedad de Lyme: una revisión. Curr Allergy Asthma Rep. 2010;10:13-20.
7. Johnson SE, Klein GC, Schmid GP, Feeley JC. Susceptibilidad de la espiroqueta de la enfermedad de Lyme a siete agentes antimicrobianos. Yale J Biol Med. 1984;57:549-553.
8. Agger WA, Callister SM, Jobe DA. In vitro susceptibilidades de Borrelia burgdorferi a cinco cefalosporinas orales y ceftriaxona. Antimicrob Agents Chemother. 1992;36:1788-1790.
9. Luft BJ, Dattwyler RJ, Johnson RC, et al. Azitromicina comparada con amoxicilina en el tratamiento del eritema migratorio. Un ensayo doble ciego, aleatorizado y controlado. Ann Intern Med. 1996;124:785-791.
10. Terekhova D, Sartakova ML, Wormser GP, et al. Erythromycin resistance in Borrelia burgdorferi. Antimicrob Agents Chemother. 2002;46:3637-3640.
11. Steere AC, Hutchinson GJ, Rahn DW, et al. Tratamiento de las primeras manifestaciones de la enfermedad de Lyme. Ann Intern Med. 1983;99:22-26.
12. Eppes SC, Childs JA. Estudio comparativo de cefuroxime axetil frente a amoxicilina en niños con enfermedad de Lyme temprana. Pediatrics. 2002;109:1173-1177.
13. Feder H, Johnson B, O’Connell S, et al. Una valoración crítica de la «enfermedad de Lyme crónica». N Engl J Med. 2007;357:1422-1430.
14. Lexi-Comp Online . Hudson, OH: Lexi-Comp, Inc; 2010.
15. Kowalski TJ, Tata S, Berth W, et al. Duración del tratamiento antibiótico y resultados a largo plazo de los pacientes con enfermedad de Lyme temprana de un área hiperendémica de la enfermedad de Lyme. Clin Infect Dis. 2010;50:512-520.
16. Dattwyler RJ. Un comentario sobre el tratamiento de la enfermedad de Lyme temprana. Clin Infect Dis.
17. Bacon RM, Kugeler KJ, Mead PS. Surveillance for Lyme disease–United States, 1992-2006. MMWR Surveill Summ. 2008;57:1-9.
18. CDC. Reported cases of Lyme disease by year, United States, 1994-2008.www.cdc.gov/ncidod/dvbid/lyme/ 2010;50:521-522.ld_UpClimbLymeDis.htm. Consultado el 23 de abril de 2010.