INTRODUCIENDO LOS ANHÍDRIDOS ÁCIDOS
Esta página explica qué son los anhídridos ácidos y examina sus propiedades físicas simples, como los puntos de ebullición. Introduce su reactividad química de forma general, pero los detalles de las reacciones específicas se dan en páginas separadas – ver el menú de anhídridos ácidos (enlace al final de la página).
¿Qué son los anhídridos ácidos?
La estructura de los anhídridos ácidos
Un ácido carboxílico como el ácido etanoico tiene la estructura:
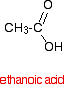
Si tomases dos moléculas de ácido etanoico y les quitaras una molécula de agua entre ellas obtendrías el anhídrido ácido, anhídrido etanoico (nombre antiguo: anhídrido acético).
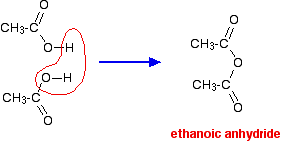
En realidad, se puede hacer anhídrido etanoico deshidratando el ácido etanoico, pero normalmente se hace de una manera más eficiente y con rodeos. (Hacer anhídrido etanoico está fuera del alcance del nivel A del Reino Unido.)
Nombrar anhídridos ácidos
Esto es realmente fácil. Sólo tienes que tomar el nombre del ácido padre, y sustituir la palabra «ácido» por «anhídrido». «Anhídrido» significa simplemente «sin agua».
Así que… el ácido etanoico forma anhídrido etanoico; el ácido propanoico forma anhídrido propanoico, y así sucesivamente.
Para los propósitos del nivel A del Reino Unido, el único que es probable que encuentres es el anhídrido etanoico.
Propiedades físicas de los anhídridos ácidos
Tomaremos el anhídrido etanoico como típico.
Aparición
El anhídrido etanoico es un líquido incoloro, que huele fuertemente a vinagre (ácido etanoico).
El olor se debe a que el anhídrido etanoico reacciona con el vapor de agua del aire (y la humedad de la nariz) para producir de nuevo ácido etanoico. Esta reacción con el agua se da en detalle en otra página. (Encuéntrala en el menú de anhídridos ácidos – enlace al final de esta página.)
Solubilidad en agua
No se puede decir que el anhídrido etanoico se disuelva en agua porque reacciona con ella para dar ácido etanoico. No existe una solución acuosa del anhídrido etanoico.
Punto de ebullición
El anhídrido etanoico hierve a 140°C. Esto se debe a que es una molécula polar bastante grande, por lo que tiene tanto fuerzas de dispersión de Van der Waals como atracciones dipolo-dipolo.
Sin embargo, no forma enlaces de hidrógeno. Esto significa que su punto de ebullición no es tan alto como el de un ácido carboxílico de tamaño similar. Por ejemplo, el ácido pentanoico (el ácido de tamaño más similar) hierve a 186°C.