Pregunta guía
¿Qué factores determinan la exactitud y la precisión de la concentración de ácido acético en el vinagre?
Introducción
Muchos laboratorios analizan productos de consumo para determinar la exactitud en el etiquetado del producto. En este experimento se demuestra la técnica muy común y sencilla de la valoración. Una titulación es un procedimiento analítico en el que se ejecuta una reacción bajo condiciones cuidadosamente controladas. Se mide el volumen estequiométrico de un reactivo de concentración conocida, el valorante, que se requiere para reaccionar con otro reactivo de concentración desconocida, el analito. La concentración del analito se determina a partir de la concentración y el volumen del valorante y de la estequiometría de la reacción entre ambos. El montaje experimental se muestra en la figura 1. Una bureta, que contiene el valorante, está calibrada para que el volumen de solución que entrega pueda determinarse con gran exactitud y precisión. El titrante se añade al analito hasta que se haya añadido el volumen estequiométrico de titrante. Esto se denomina punto de equivalencia, en el que se lee el volumen de valorante suministrado por la bureta. Normalmente, las lecturas de volumen se estiman con una precisión de 0,01 mL. La entrega del titrante se ajusta con la llave de paso de la bureta. Con la práctica, uno puede dispensar fracciones de una gota de titulante y controlar el procedimiento lo suficientemente bien como para que las titulaciones replicadas coincidan dentro de 0,10 mL. Para este primer laboratorio, necesitarás que tus valoraciones coincidan dentro de 0,50 mL.
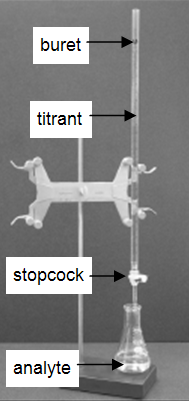
Figura 1: Configuración de la valoración
A menudo, el punto de equivalencia se determina visualmente con un indicador. El indicador, que es una sustancia que cambia de color cerca del punto de equivalencia, se añade a la solución del analito. Dado que el cambio de color se produce cerca del punto de equivalencia, pero no exactamente, el punto en el que se produce el cambio de color se denomina punto final. Los indicadores se eligen de manera que el punto final esté muy cerca del punto de equivalencia. Es importante mantener una valoración bien mezclada, para que el valorante y el analito puedan entrar en contacto y reaccionar rápidamente. Se puede utilizar la agitación manual del matraz o la agitación mecánica. En este experimento utilizarás la agitación manual. El tipo más común de valoración es la valoración ácido-base. En este experimento, determinarás la concentración de ácido acético, HC2H3O2 en vinagre comercial. En esta valoración, el NaOH acuoso es el valorante y el vinagre es el analito. Suponemos que la base fuerte y el ácido débil reaccionan completamente según la ecuación neta:
La ecuación equilibrada muestra una estequiometría 1:1, por lo que podemos escribir:
O más generalmente:
Como recordatorio sobre las unidades de concentración, la molaridad se define como el número de moles de soluto en un litro de solución (M = mol/L). Esto es numéricamente igual al número de milimoles de soluto en un mililitro de solución (M = mmol/mL). A menudo es conveniente utilizar esta segunda definición de molaridad en las valoraciones y otros trabajos en los que intervienen pequeñas cantidades. Hay 1000 mmol en 1 mol y 1000 mL en 1 litro. Por ejemplo, 10,2 mL de solución de NaOH 0,100 M contienen 1,02 mmol de NaOH.
0.100 mmol de NaOH
1 mol de solución
= 1,02 mmol de NaOH
En este experimento, se coloca un volumen cuidadosamente medido de vinagre
en un matraz y se determina la masa. A continuación se valora la muestra de vinagre con una solución de NaOH de concentración conocida
y se determina el volumen de solución de NaOH necesario para alcanzar el punto final
.
y
son conocidos, por lo que la concentración del ácido
puede determinarse como se ha descrito anteriormente. Además, la masa de ácido acético en la muestra puede determinarse a partir del número de moles presentes y la masa molar del ácido acético
Finalmente, el porcentaje en masa de ácido acético en el vinagre puede determinarse a partir de la masa del ácido acético en la muestra y la masa de la solución de vinagre que se tituló.
masa de ácido acético en la muestra
masa de la solución de vinagre valorada
× 100
En la valoración del ácido acético con NaOH acuoso, se utiliza fenolftaleína como indicador. La fenolftaleína es casi incolora en una solución ácida pero se vuelve rosa a un pH de aproximadamente 8. Esto indica que la base ha neutralizado todo el ácido. Al valorar el vinagre, observarás que el color rosa es más persistente a medida que añades más base. Esta es una señal para ralentizar la adición de base y controlarla cuidadosamente. El punto final se ha alcanzado cuando persiste un tenue color rosa durante al menos 30 segundos. Es fácil sobrepasar el punto final. Si esto ocurre, tendrás una solución de color rosa púrpura oscuro, y tendrás que repetir la valoración, así que ten cuidado. Anota el volumen que has utilizado, detente por debajo de este volumen en las siguientes valoraciones y añade el último mililitro más o menos gota a gota. Tu instructor te mostrará cómo controlar la llave de paso de la bureta para facilitar esto. Ten en cuenta que las mediciones de volumen en las valoraciones se reportan generalmente con cuatro cifras significativas, por lo que las concentraciones también se reportan generalmente con cuatro cifras significativas. Observa esto en tu trabajo; cuando calcules las masas molares, asegúrate de tener cuatro cifras significativas.
Objetivos
Al completar esta investigación podrás:
-
1
Estandarizar una solución de NaOH(aq).
-
2
Valorar una muestra de vinagre con la solución estandarizada de NaOH(aq).
-
3
Mide la densidad de una muestra de vinagre.
-
4
Calcula la molaridad y el porcentaje en masa de ácido acético en la muestra de vinagre.
Materiales disponibles para su uso
- Vinagre
- Solución de NaOH(aq)
- KHP – ftalato de hidrógeno de potasio
- Indicador de fenolftaleína
- Pipas de 10 mL
- Vasos
- Matera de Erlenmeyer, 125 mL
- Soporte de bureta con bureta
- Túnel
- Balanzas analíticas
Precauciones de seguridad
El NaOH es corrosivo. Puede atacar la piel y causar daños permanentes en los ojos. Si la solución de NaOH le salpica a los ojos, utilice la estación de lavado de ojos inmediatamente. Mantenga los ojos abiertos y lávelos con agua. Si entra en contacto con la piel o la ropa, lave la zona afectada con agua. Haga que su compañero de laboratorio notifique a su instructor sobre el derrame.
Comenzando
Tu primera tarea es estandarizar la solución de NaOH usando KHP sólido (KC8H5O4, 204,22 g/mol). Esto significa que debes determinar su molaridad con al menos tres cifras significativas. Necesitarás al menos tres valoraciones que concuerden dentro del 1% como se describe en el procedimiento. Tienes otras dos tareas que realizar en el laboratorio. Debes determinar la densidad de la solución de vinagre y la molaridad del ácido acético en vinagre. Para llevar a cabo tus tareas, deberás realizar mediciones de volumen y masa muy precisas. Las buretas y las pipetas son útiles para medir con precisión los volúmenes. La bureta y la pipeta se describen en la introducción y en los vídeos. Antes de empezar, asegúrate de que entiendes su uso correcto.
Procedimiento
Por favor, imprime la hoja de trabajo para este laboratorio. Necesitarás esta hoja para registrar tus datos.

Preparación de la bureta
Revisa la bureta enjuagando los lados con una botella de agua destilada para comprobar si el agua «se extiende» por el interior de la bureta. Si se observan gotas de agua, la bureta debe ser lavada antes de su uso. Tenga cuidado de no rayar la superficie interior si es necesario utilizar un cepillo para buretas para limpiarla. Enjuague bien la bureta con agua del grifo, incluyendo la llave de paso y las arandelas. A continuación, aclare las paredes de la bureta con agua desionizada/destilada.
Por último, enjuaga la bureta al menos DOS veces con pequeñas porciones de tu solución de NaOH para asegurarte de que se elimina toda el agua. Eche la solución por la punta.
Llena la bureta con solución de NaOH utilizando un embudo.
Para eliminar las burbujas de aire atrapadas en la punta de la bureta después del llenado, abra y cierre rápidamente la llave de paso varias veces. Nota: Si la llave de paso se alinea correctamente con la punta de la bureta, las burbujas atrapadas no son tan frecuentes. Consulte con el instructor si la burbuja persiste.
Estandarización con KHP
Utilice ~1 gramo de KHP. REGISTRAR INMEDIATAMENTE LA MASA EN LA TABLA DE DATOS.
Utilizar la botella de lavado con agua destilada para asegurarse de que todas las muestras han sido transferidas al matraz.
Añade unos 50 mL de agua destilada y dos o tres gotas de indicador. En este experimento de valoración se utilizará el indicador fenolftaleína. No utilices demasiado indicador o también estarás valorando esa molécula. Sea consistente en usar el mismo número de gotas en todas las muestras.
Técnica de valoración
Coloca una hoja de papel blanco debajo del matraz receptor para observar más fácilmente el punto final.
Utilice una tarjeta dividida en blanco arriba/negro abajo para ayudar a leer el menisco. Colocando la tarjeta detrás de la bureta y la línea negra justo debajo del menisco se oscurece el menisco para facilitar su lectura. Registre el volumen inicial de la solución de NaOH hasta la centésima de mililitro más cercana (±0,01 mL) en la tabla de datos de su cuaderno.
El valorante (la solución de NaOH en la bureta) puede añadirse con bastante rapidez al principio, pero a medida que se acerca el punto final, la velocidad de adición debe reducirse. Si eres diestro, es más rápido añadir el valorante con la mano izquierda mientras se agita con la derecha (viceversa para los zurdos). A medida que se acerque el punto final, el color rosa persistirá cada vez más. Cerca del punto final, enjuaga las paredes del matraz con agua destilada para asegurarte de que toda la base de NaOH añadida ha reaccionado.
Cuando esté muy cerca del punto final, suspenda una media gota de base en la punta de la bureta y enjuague la gota en el matraz receptor con la botella de lavado de agua destilada. Otro método utilizado para añadir una fracción de gota es girar la llave de paso 180 grados muy rápidamente; sin embargo, puede añadir inadvertidamente demasiada base si realiza esta técnica incorrectamente.
El punto final se produce cuando la fenolftaleína cambia de transparente al color rosa más tenue que se pueda ver y persiste durante un mínimo de 30 segundos. Registre el volumen final de la solución de NaOH hasta la centésima de mililitro más cercana (±0,01 mL) en la tabla de datos. A continuación, determine la cantidad de solución de NaOH utilizada en la valoración.
Su grupo debe completar un MÍNIMO de CUATRO ENSAYOS y tres ensayos deben coincidir DENTRO de ±1%. En realidad puede hacer más dependiendo de su técnica. NO PUEDE SIMPLEMENTE «TACHAR» LOS DATOS PORQUE NO LE GUSTEN; DEBE INDICAR LA RAZÓN PARA DESCARTARLOS. La razón puede ser obvia, como «sobrepasar el punto final», o puede que sólo pueda descartar el valor basándose en pruebas estadísticas.
Molaridad del ácido acético en el vinagre
Acondiciona la bureta con NaOH estandarizado de la semana anterior.
Acondicionar una pipeta de 10 mL con la solución de vinagre.
Mide 10 mL de vinagre en un matraz Erlenmeyer y añade el indicador de fenolftaleína.
Valorar con el NaOH estándar del laboratorio anterior.
Sesión de pósteres interactivos
Una vez que su grupo haya completado su trabajo, prepare una pizarra que pueda utilizar para compartir y justificar sus ideas. Consulte el folleto proporcionado para obtener detalles sobre este proceso.
Informe
Una vez que haya completado su investigación, deberá preparar un informe de investigación que conste de tres secciones. Este informe puede requerir más de dos páginas con tablas de datos. Este informe debe estar mecanografiado y cualquier diagrama, figura o tabla debe estar incrustado en el documento.
- Sección 1: ¿Qué concepto y/o técnica estaba investigando y cómo se relaciona con la pregunta guía? ¿Qué factores determinan la exactitud y la precisión de la concentración de ácido acético en el vinagre? Describa la valoración y su uso junto con la estequiometría molar para determinar la concentración.
- Sección 2: ¿Cómo realizó su trabajo y por qué llevó a cabo su investigación de esta manera? Específicamente, ¿qué medidas tomó para asegurar la exactitud y la precisión?
- Sección 3: El argumento en esta investigación no es tanto por su resultado como por la validez y fiabilidad de sus datos. Este informe debe incluir una tabla de datos completa similar a la que utilizó en el ejercicio de pre-laboratorio donde encontró la molaridad de su base. No informe sobre el proceso de estandarización de la base, aparte de informar sobre la molaridad del NaOH con la desviación estándar. Debe justificar el descarte de cualquiera de los ensayos de valoración con vinagre. Debes mostrar un cálculo completo de la molaridad y el % de masa del vinagre. Tu respuesta final para la molaridad del vinagre debe incluir una desviación estándar.
- Esta tercera sección es donde no sólo presentas tus datos, sino que utilizas los valores que obtienes como evidencia en tu razonamiento. Declaraciones como, «ver tabla de datos para los valores» no son aceptables!