Annals of Neurosciences, Volume 15, Issue 4 (October), 2008
Anurag Tripathi1, UC Srivastava2
1Department of Zoology, Ranchi College,(Ranchi University) Ranchi
2Department of Zoology, Universidad de Allahabad, Allahabad, India – 211 002
Autor de la respuesta
Dr. UC Srivastava
Profesor de Zoología
Departamento de Zoología, Universidad de Allahabad
Allahabad, India – 211 002
Teléfono : 93351 20178
E-mail : [email protected]
(Fecha de recepción: 08.09.2008)
Resumen
La acetilcolinesterasa (AChE) termina la neurotransmisión en las sinapsis colinérgicas mediante la división del neurotransmisor acetilcolina. La naturaleza y la distribución de la enzima se han estudiado ampliamente en muchos invertebrados y vertebrados, incluido el ser humano, desde el punto de vista histoquímico y bioquímico. La enzima demuestra un alto grado de variabilidad en su distribución con su notable presencia en tejidos no neuronales también, lo que proporciona un tema pertinente para investigar su papel no clásico.
Recientemente ha salido a la luz mucha información sobre su estructura dinámica, la expresión de genes, su papel en la morfogénesis neuronal y la sinaptogénesis. La importancia de la AChE radica en el hecho de que es la diana de los fármacos diseñados para tratar la miastenia gravis, el glaucoma, la enfermedad de Alzheimer, etc.
Teniendo en cuenta los hechos mencionados, en el presente artículo se ha realizado una revisión exhaustiva de su bioquímica, dinámica estructural, amplia distribución, isoformas y sus implicaciones en los trastornos neurodegenerativos.
Palabras clave : Acetilcolinesterasa, Colinérgica, Formas moleculares, Trastornos neurodegenerativos, Enfermedad de Alzheimer.
Introducciones
La acetilcolinesterasa (AChE) es una de las enzimas más eficientes del sistema nervioso que se concentra en las sinapsis colinérgicas y en las sinapsis neuromusculares donde hidroliza rápidamente el neurotransmisor acetilcolina (Ach) en colina y acetato desempeñando así un papel esencial en la neurotransmisión colinérgica.
El término acetilcolinesterasa fue introducido en 1949 por Augustintion y Nachmansohn para referirse a la colinesterasa específica capaz de hidrolizar la acetilcolina más rápidamente que otras esterasas. En 1964, la comisión de enzimología recomendó el nombre de «acetilcolinesterasa» (acetil hidrolasa de la acetilcolina; 3.1.1.7) para una colinesterasa verdadera y específica.
La distribución de la enzima en los tejidos nerviosos centrales y periféricos de diferentes vertebrados demuestra un alto rango de variación (1-13). Se ha observado que también se localiza en tejidos no neuronales y en células gliales (14, 15). La enzima también exhibe una diversidad molecular con sus seis formas moleculares diferentes y su dinámica estructural, lo que facilita su afinidad y acción con varias leyendas (16-17). Además, se considera que la AChE desempeña varias funciones no clásicas independientes de su función catalítica, es decir, la hidrólisis de la Ach. Estas funciones clásicas y no clásicas de la AChE ilustran la idoneidad de su amplia presencia en los tejidos neuronales y no neuronales (18-20).
La importancia de la AChE en la homeostasis del organismo se ve subrayada por el hecho de que son las dianas de algunas de las toxinas más potentes, incluidos los insecticidas, el veneno de serpiente y las armas químicas (21).
Por lo tanto, una distribución tan amplia y varias funciones, formas moleculares, dinámica estructural, etc. La estructura tridimensional de la AChE fue determinada por primera vez por Joel Sussman et.al. en 1991, utilizando la proteína de T. californica (22). Las estructuras de los dominios catalíticos de las AChEs de especies como T. californica, el ratón y el ser humano son bastante similares (fig.1) (23, 24).
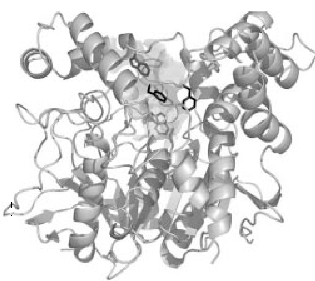
Figura 1. Diagrama de cinta tridimensional de la acetilcolinesterasa de Torpedo Californica.
La acetilcolinesterasa es una serina hidrolasa que pertenece a la familia de las corboxiesterasas de tipo B dentro de los eucariotas superiores. Es una molécula elipsoidal de aproximadamente 45× 60×65 A0, que consiste en una hoja beta mixta de 12 hebras rodeada por 14 hélices alfa. (22). Es un monómero en su estado natural con un peso molecular alrededor de 60.000 y forma agregados que siguen produciendo actividad catalítica.
El sitio activo está compuesto por dos subsitios, el subsitio estérico que tiene la tríada catalítica (Ser-His-Glu) y el subsitio aniónico de unión periférica (PAS) que aloja el polo cuaternario positivo de la Ach. ( Fig. 2a)
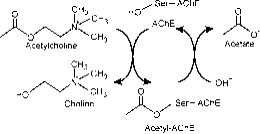
Figura 2a: Diferentes sitios de la AChE; El sitio catalítico se encuentra en un desfiladero profundo.
El subsitio estérico contiene la maquinaria catalítica de la enzima, una tríada de Ser 200, His-440 y Glu-327 (los números designan la secuencia de aminoácidos en la cadena polipeptídica). Esta tríada es similar a la de otras serinproteasas, excepto que la tríada es la primera en mostrar Glu como tercer miembro en lugar de Asp. Además, la tríada es de mano opuesta a la de las otras proteasas. El subsitio aniónico está definido por Trp 84, Phe 330, Phe 331. Su función es orientar la parte cargada del sustrato que entra en el sitio activo. Esto lo lleva a cabo principalmente la Trp. 84 (22).
El desfiladero aromático en la proteína tiene una profundidad de aproximadamente 20 angstrom y penetra hasta la mitad de la enzima. El sitio activo se encuentra en la base de este desfiladero a sólo 4 angstrom por encima de la base. El desfiladero aromático es un término más apropiado porque el 40% de su revestimiento está compuesto por 14 residuos aromáticos que están altamente conservados en diferentes especies de AChE (25).
El sitio aniónico periférico tiene la capacidad de unirse a muchos tipos diferentes de ligandos por lo que afecta a la confirmación del sitio activo. Seis residuos estabilizan la actividad dentro del sitio. Trp 286, Ty r 72, Tyr 124, Glu 285, Asp 74, Tyr 341 situados en el sitio opuesto de la entrada del desfiladero. Este conjunto de residuos proporciona una flexibilidad que acomoda muchos ligandos y también implica su movilidad de confirmación. La AChE cataliza la hidrólisis de la AChE de la siguiente manera (Fig. 2b):
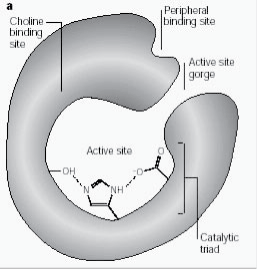
Figura 2b: Reacción del sustrato de la enzima que ilustra la hidrólisis de la acetilcolina.
La dinámica molecular de la AChE se mantiene a través del mecanismo de conversación cruzada en el que la interacción entre dos subsitios tiene lugar particularmente entre los residuos Trp 286, Trp 86. Cuando el Trp 286 se une en la periferia afecta al Trp 86 en el sitio activo y provoca un sitio de confirmación distinto. Asp 74 también juega un papel en la modulación alostérica de la enzima. La sensibilidad de estos residuos y la plasticidad del sitio activo son probablemente el resultado de un diseño evolutivo dirigido a conferir una actividad óptima bajo una amplia veriedad de condiciones (26.)
Ocurrencia
La enzima AChE está presente en alta concentración en todos los tipos de tejidos conductores, nerviosos y musculares, tejidos centrales y periféricos, fibras motoras y sensoriales, fibras simpáticas y parasimpáticas llamadas colinérgicas y no colinérgicas y en todas las regiones donde se localizan los cuerpos celulares y las uniones, la concentración de la enzima es elevada(27). Con los métodos histoquímicos, la AChE se demuestra generalmente en las estructuras neuronales: perikarya, membranas superficiales, axones, dendritas y regiones sinápticas 4, 15, 28-30). La actividad de la AChE es mayor en las neuronas motoras que en las sensoriales (4, 15, 31). Generalmente se reconoce que la acetilcolinesterasa en los tejidos nerviosos representa a las neuronas que contienen y presumiblemente liberan acetilcolina como neurotransmisor (32).
Los primeros estudios sobre el lugar de síntesis de la AChE dentro del tejido nervioso indicaban un origen dentro del cuerpo celular de la neurona (33-35). Se ha descubierto que la enzima está asociada al retículo endoplásmico del cuerpo celular y al aparato de Golgi (8, 36). La AChE también se ha asociado en fracciones subcelulares del cerebro con fracciones microsomales y mitocondriales crudas (2, 37). El fraccionamiento posterior de la fracción mitocondrial cruda del tejido cerebral mostró altos niveles de actividad de la AChE en la fracción de la membrana sinaptosomal (6).
Se encontró que la mayor parte de la AChE se localizaba en los axones y se asociaba a la membrana axonal (9). La actividad de la colinesterasa limitada a los axones, se ha observado en las vesículas axonales de todas las fibras nerviosas no mielinizadas y de algunas mielinizadas (38). Las fibras nerviosas mielinizadas tienen en general una concentración menor que las llamadas no mielinizadas y la sustancia blanca contiene mucha menos AChE que la materia gris (27). En las motoneuronas aisladas, la actividad de la AChE es unas diez veces mayor en el citoplasma, las dendritas y los axones que en el nucleoplasma y no hay actividad en el nucleolo (39). Se ha demostrado que las células gliales contienen AChE en concentraciones variables (14, 15)
Roles clásicos y no clásicos
El curso completo de la transmisión colinérgica, especialmente en la unión neuromuscular, es decir, la liberación de Ach, su difusión a través de la hendidura sináptica, su interacción reversible con el receptor nicotínico de Ach y, finalmente, la hidrólisis por parte de la AChE, se produce en unos pocos milisegundos. Todo el proceso está estrechamente integrado tanto espacial como temporalmente (40). De acuerdo con su función clásica, su tiempo de giro es de 150 useg, lo que equivale a la hidrólisis de 5000 moléculas de Ach/molécula de enzima/seg. Hidroliza el sustrato con tanta rapidez que la concentración alrededor de la molécula de enzima se agota en relación con su concentración en la solución global.
Desde hace más de veinte años, se supone que la AChE desempeña otras funciones, además de su papel clásico en la terminación de la transmisión sináptica. Estas funciones no clásicas de la AChE podrían implicar la hidrólisis de Ach en un contexto no sináptico. Se ha informado de que el péptido terminal C de 26 residuos ARP (péptido de lectura de la acetilcolinesterasa) de la AChE humana, que se produce cuando la variante de empalme R es inducida por el estrés, modula la diferenciación hematopoyética (41).
Varios estudios in vivo e in vitro en el sistema nervioso central sugirieron que la enzima AChE regulada por el desarrollo desempeña un papel en funciones no colinérgicas como los procesos morfométricos, la diferenciación celular y la sinaptogénesis a lo largo del sistema nervioso (20).Existen amplios estudios que sugieren que una de las funciones no clásicas de la AChE puede ser la de proteína de adhesión implicada en el desarrollo y mantenimiento sináptico (42). Otras evidencias implican a la AChE como proteína de la matriz ósea, y recientemente se ha demostrado que interactúa con la proteína del sótano, la laminina (43, 44).
Varios estudios han demostrado que la AChE está implicada en el crecimiento de las neuritas. Las formas de AChE que hidrolizan Ach pero que carecen del corboxi-terminal (responsable de las actividades neuritogénicas), los dominios neuríticos no lograron mejorar el crecimiento neurítico demostrando la independencia de la actividad catílica y neuritogénica entre sí (19). También se ha propuesto que la AChE desempeña múltiples funciones en la embriogénesis. Los peces cebra proporcionan un sistema excelente para investigar las funciones invivo de la AChE durante la embriogénesis. Se identificó una mutación de missencia en el gen ache del pez cebra que suprime la hidrólisis de Ach pero deja intacto el corboxi-terminal neuritogénico (45). También se informó de que los embriones mutantes de ache presentaban defectos en el desarrollo de las fibras musculares y en la supervivencia y el crecimiento dendrítico de las neuronas sensoriales primarias. Estos defectos se interpretaron colectivamente como un apoyo a las funciones no clásicas de la AChE.
Hay amplias evidencias que apoyan su papel en la hidrólisis de la sustancia P, met, leu-enkefalina y la degradación de otros neuropéptidos también (46, 47).
También se ha propuesto que la AChE funciona en la morfogénesis del corazón. La actividad de la AChE se detecta en corazones embrionarios de rata y pollo antes de la inervación (48, 49). Aunque su función en el corazón embrionario no está clara, se ha propuesto que la AChE regula el sistema de conducción de los impulsos embrionarios (50). Sin embargo, se necesitan funciones adicionales para seguir explorando el papel de la AChE en la función cardíaca.
Se ha demostrado que la AChE acelera el ensamblaje del péptido αβ en las fibrillas amiloides probablemente a través de la interacción en el sitio periférico (51-53).También se ha demostrado que los complejos AChE / αβ muestran una mayor neurotoxicidad en comparación con las fibrillas que sólo contienen αβ (54).
En un contexto farmacológico los estudios revelaron que las actividades no clásicas de la AChE parecen converger en el sitio aniónico periférico. Por lo tanto, podría preverse que en el futuro se desarrollen nuevas categorías de inhibidores de la AChE.
Diversidad molecular
La enzima AChE se presenta en una serie de formas moleculares que difieren tanto en su estructura cuaternaria como en el modo de anclaje dentro de la sinapsis generada por el empalme alternativo del exón terminal C de un único gen, seguido de una modificación postraduccional (55, 56). La acetilcolinesterasa (AChE) existe en seis formas diferentes (isoenzimas): monómero globular (G1), dímero (G2) y tetrámero (G4); tetrámero con cola (A4), tetrámero con doble cola (A8) y tetrámero con triple cola (A12) ( fig. 3). La terminología más racional basada en esta información es la desarrollada por Bon et al. (1982). En su sistema las formas globulares se designan por «G» y las formas de cola por «A».
Las formas monoméricas y las de cola con enlaces disulfuro pueden ser solubles o estar unidas a una membrana por un glicofosfolípido. Las formas tetrámero pueden ser solubles, estar unidas a una membrana por un lípido o estar unidas a una triple hélice de colágeno. Las formas monoméricas se incorporan generalmente a las sinapsis del sistema nervioso central de los vertebrados, mientras que en las uniones neuromusculares las tres subunidades catalíticas de los tetrámeros están unidas a una cola de colágeno de triple hélice que las ancla a la lámina basal dentro de la hendidura sináptica.
Se ha observado que la expresión de las formas moleculares de la AChE, en Torpedo, es específica del tejido, lo que sugiere que el polimorfismo exhibido por la AChE depende de una serie de factores que incluyen
la cantidad de Ach liberada
el tamaño del espacio sináptico y/o
el curso temporal de la estimulación fisiológica.(58)
Regulación de la expresión de la AChE en las neuronas
En los últimos años se han realizado amplios estudios para desentrañar los mecanismos y vías moleculares implicados en la expresión y localización de la AChE en los tejidos neuronales y no neuronales. La AChE se expresa en gran medida durante la diferenciación neuronal. Se ha observado que la región no traducida (UTR) de la AChE contiene un elemento rico en AU (ARE) que interactúa directamente con la proteína de unión al ARN «HuD», lo que da lugar a la abundancia de transcritos de AChE en las células neuronales (59). Estos hallazgos muestran la importancia de los mecanismos post-transcripcionales en la regulación de la expresión de AChE en las neuronas en diferenciación e implican a ‘HuD’ como un factor clave de acción trans en estos eventos. Sin embargo, hay otros factores reguladores que rigen la estabilidad, la localización y la traducción de los transcritos de AChE. Muchos elementos que actúan en cis y factores y proteínas que actúan en trans interactúan con la AChE – 3′-UTR. (59).
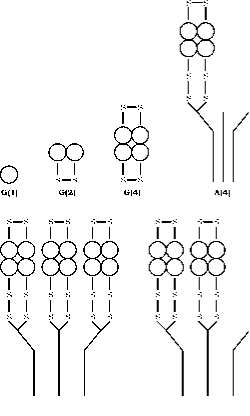
Figura 3. Estructura cuaternaria de las seis formas principales de AChE. Las formas globulares están representadas por G y las asimétricas por A según el esquema de Bon et. al. (16). La localización de los puentes disulfuro y el modo de unión a la cola de colágeno se diagraman según el modelo construido por Anglister y Silman.(57)
AChE en trastornos neurodegenerativos y neuromusculares :
La acetilcolinesterasa se ha relacionado directamente con ciertos trastornos neuromusculares como la miastenia gravis,el glaucoma (60), y más recientemente para paliar la deficiencia colinérgica asociada a la enfermedad de alzheimer (61).
Clinicamente, la inhibición moderada de la AChE es eficaz en el tratamiento de estas enfermedades para prolongar el efecto de la ACh sobre el receptor Dicho tratamiento es deseable tanto si hay una concentración reducida de ACh, como en el caso de la enfermedad de Alzheimer, como si hay menos receptores, como en el caso de la miastenia gravis. Los inhibidores actualmente aprobados por la FDA estadounidense para el tratamiento de la enfermedad de Alzheimer son el E2020 (donepezilo, Aricept), la tacrina (Cognex), la rivastigmina (Exelon) y la galantamina (Reminyl)(62). Los inhibidores para el tratamiento de la miastenia gravis incluyen la piridostigmina (Mestinon) y la neostigmina (Prostigmine (63). Sin embargo, la inhibición abrumadora de la AChE, en particular mediante la unión covalente a la serina del sitio activo, es invariablemente letal. Por lo tanto, la AChE es una diana principal para las toxinas de origen natural como la fasciculina II del veneno de serpiente, los pesticidas como el paratión y el malatión, y los agentes de guerra química como el sarín, el tabún y el VX (64)
Conclusiones
En el presente artículo, hemos estudiado en primer lugar los resultados recientes relacionados con la bioquímica y la estructura molecular de la AChE, que proporciona la enzima única, la flexibilidad para encontrar diversas leyendas y también para exhibir una alta tasa de cambio. También hemos ilustrado su amplio patrón de distribución histoquímica en los tejidos neuronales y no neuronales, que puede correlacionarse además con sus funciones clásicas y no clásicas que se han revisado. Los estudios adicionales sobre la regulación de la expresión de la AChE, que desvelan la importancia de estos eventos post-transcripcionales in vivo, son de suma importancia porque, en última instancia, podrían conducir al diseño de estrategias terapéuticas adicionales destinadas a promover la regeneración y la supervivencia neuronal. Los recientes avances en la biología de la AChE, en particular sus implicaciones en ciertos trastornos neurodegenerativos, son de un interés clave que se ha revisado brevemente. Esta investigación está dando lugar a la producción de nuevas clases de inhibidores de la AChE dirigidos contra sus PAS (sitios aniónicos periféricos), que podrían desempeñar un doble papel en el contexto de la enfermedad de Alzheimer al inhibir simultáneamente la hidrólisis de la acetilcolina y retrasar el ensamblaje del péptidoá â en la fibra amiloide.
Abreviaturas
AChE: acetilcolinesterasa; ARP: péptido de lectura de acetilcolinesterasa; Ach: acetilcolina; UTR: región no traducida; ARE: elemento rico en AU; PAS: sitio aniónico periférico; Glu: ácido glutámico; His: histidina; Ser: serina; Asp: ácido aspártico; Trp: triptófano; Tyr: tirosina; Phe: fenil alanina.