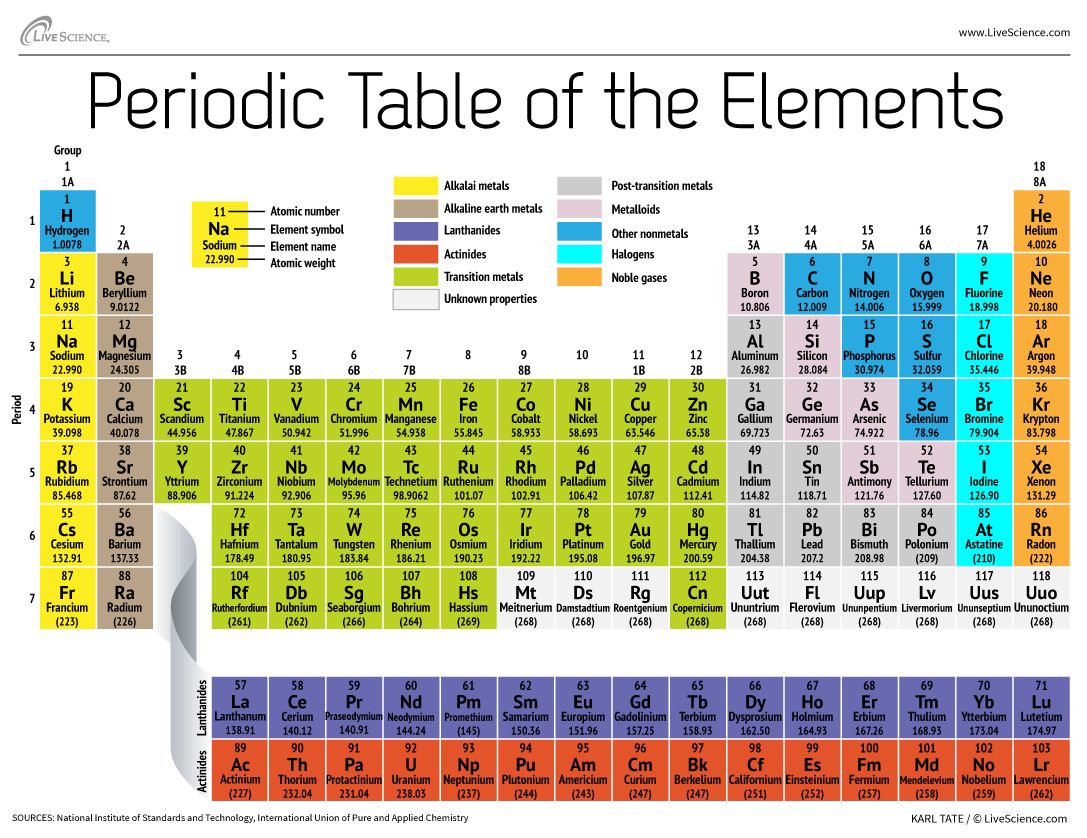
La tabla periódica de los elementos ordena todos los elementos químicos conocidos en un conjunto informativo. Los elementos están ordenados de izquierda a derecha y de arriba a abajo en orden de número atómico creciente. El orden suele coincidir con el aumento de la masa atómica.
Las filas se denominan períodos. El número de período de un elemento significa el nivel de energía más alto que ocupa un electrón de ese elemento (en el estado no excitado), según el Laboratorio Nacional de Los Álamos. El número de electrones de un período aumenta a medida que se desciende en la tabla periódica; por lo tanto, a medida que aumenta el nivel de energía del átomo, aumenta el número de subniveles de energía por nivel de energía.
Los elementos que ocupan la misma columna en la tabla periódica (llamada «grupo») tienen configuraciones de electrones de valencia idénticas y, en consecuencia, se comportan químicamente de forma similar. Por ejemplo, todos los elementos del grupo 18 son gases inertes.
«Padre» de la tabla periódica
Dmitri Mendeléyev, químico e inventor ruso, es considerado el «padre» de la tabla periódica, según la Real Sociedad de Química. En la década de 1860, Mendeléyev era un popular profesor de una universidad de San Petersburgo (Rusia). Como en aquella época no había libros de texto de química orgánica moderna en ruso, Mendeléyev decidió escribir uno y, al mismo tiempo, abordar el problema de los elementos desordenados.
Poner los elementos en algún tipo de orden resultaría bastante difícil. En ese momento, se conocían menos de la mitad de los elementos, y algunos de ellos habían recibido datos erróneos. Era como trabajar en un rompecabezas realmente difícil con solo la mitad de las piezas y con algunas de ellas deformadas.
Mendeleev acabó escribiendo el libro de texto de química definitivo de su época, titulado «Principios de Química» (dos volúmenes, 1868-1870), según Khan Academy. Mientras trabajaba en él, se encontró con un importante descubrimiento que contribuiría en gran medida al desarrollo de la actual tabla periódica. Tras escribir las propiedades de los elementos en tarjetas, comenzó a ordenarlos por peso atómico creciente, según la Royal Society of Chemistry. Fue entonces cuando se dio cuenta de que ciertos tipos de elementos aparecían regularmente. Después de trabajar intensamente en este «rompecabezas» durante tres días, Mendeléyev dijo que había tenido un sueño en el que todos los elementos caían en su sitio como era necesario. Cuando se despertó, los anotó inmediatamente en un papel -sólo en un lugar le pareció necesaria una corrección, dijo más tarde.
Mendeleev ordenó los elementos según el peso atómico y la valencia. No sólo dejó espacio para elementos aún no descubiertos, sino que predijo las propiedades de cinco de estos elementos y sus compuestos. En 1869, presentó los resultados a la Sociedad Química Rusa. Su nuevo sistema periódico se publicó en la revista alemana de química Zeitschrift fϋr Chemie (Revista de Química).
Lectura de la tabla
La tabla periódica contiene una enorme cantidad de información importante:
Número atómico: El número de protones de un átomo se denomina número atómico de ese elemento. El número de protones define de qué elemento se trata y también determina el comportamiento químico del elemento. Por ejemplo, los átomos de carbono tienen seis protones, los de hidrógeno uno y los de oxígeno ocho.
Símbolo atómico: El símbolo atómico (o símbolo del elemento) es una abreviatura elegida para representar un elemento («C» para el carbono, «H» para el hidrógeno y «O» para el oxígeno, etc.). Estos símbolos se utilizan internacionalmente y a veces son inesperados. Por ejemplo, el símbolo del wolframio es «W» porque otro nombre para ese elemento es wolframio. Asimismo, el símbolo atómico del oro es «Au» porque la palabra para oro en latín es aurum.
Peso atómico: El peso atómico estándar de un elemento es la masa media del elemento en unidades de masa atómica (amu). Los átomos individuales siempre tienen un número entero de unidades de masa atómica; sin embargo, la masa atómica en la tabla periódica se indica como un número decimal porque es un promedio de los distintos isótopos de un elemento. El número medio de neutrones de un elemento se puede encontrar restando el número de protones (número atómico) de la masa atómica.
Peso atómico de los elementos 93-118: Para los elementos naturales, el peso atómico se calcula a partir del promedio de los pesos de las abundancias naturales de los isótopos de ese elemento. Sin embargo, para los elementos transuránicos creados en laboratorio -elementos con números atómicos superiores a 92- no existe una abundancia «natural». La convención consiste en indicar el peso atómico del isótopo más longevo de la tabla periódica. Estos pesos atómicos deben considerarse provisionales, ya que en el futuro podría producirse un nuevo isótopo con una vida media más larga.
Dentro de esta categoría se encuentran los elementos superpesados, o aquellos con números atómicos superiores a 104. Cuanto más grande es el núcleo del átomo -que aumenta con el número de protones en su interior- más inestable es ese elemento, por lo general. Como tales, estos elementos de gran tamaño son efímeros y duran apenas milisegundos antes de descomponerse en elementos más ligeros, según la Unión Internacional de Química Pura y Aplicada (IUPAC). Por ejemplo, los elementos superpesados 113, 115, 117 y 118 fueron verificados por la IUPAC en diciembre de 2015, completando la séptima fila, o periodo, de la tabla. Varios laboratorios diferentes produjeron los elementos superpesados. Los números atómicos, nombres temporales y nombres oficiales son:
- 113: ununtrio (Uut), nihonio (Nh)
- 115: ununpentium (Uup), moscovio (Mc)
- 117: ununseptio (Uus), tennessina (Ts)
- 118: ununoctio (Uuo), oganesson (Og)
Información adicional de Traci Pedersen, colaboradora de Live Science
Noticias recientes