Domanda guida
Quali fattori determinano l’accuratezza e la precisione con cui si può determinare la concentrazione di acido acetico nell’aceto?
Introduzione
Molti laboratori analizzano prodotti di consumo per determinare l’accuratezza nell’etichettatura del prodotto. La tecnica molto comune e semplice della titolazione è dimostrata in questo esperimento. Una titolazione è una procedura analitica in cui una reazione viene eseguita in condizioni attentamente controllate. Si misura il volume stechiometrico di un reagente di concentrazione nota, il titolante, che è necessario per reagire con un altro reagente di concentrazione sconosciuta, l’analita. La concentrazione dell’analita è determinata dalla concentrazione e dal volume del titolante e dalla stechiometria della reazione tra loro. Il setup sperimentale è mostrato nella Figura 1. Una buretta, che contiene il titolante, è calibrata in modo che il volume di soluzione che eroga possa essere determinato con alta accuratezza e precisione. Il titolante viene aggiunto all’analita fino a quando non è stato aggiunto il volume stechiometrico di titolante. Questo è chiamato il punto di equivalenza, al quale viene letto il volume di titolante erogato dalla buretta. Di solito, le letture del volume sono stimate al più vicino 0,01 mL. L’erogazione del titolante viene regolata con il rubinetto della buretta. Con la pratica, uno può dispensare frazioni di una goccia di titolante e controllare la procedura abbastanza bene che le titolazioni replicate concordano entro 0.10 mL. Per questo primo laboratorio, avrai bisogno che le tue titolazioni concordino entro 0,50 mL.
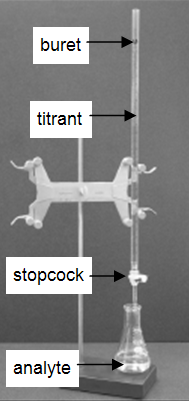
Figura 1: Impostazione della titolazione
Spesso, il punto di equivalenza è determinato visivamente con un indicatore. L’indicatore, che è una sostanza che cambia colore vicino al punto di equivalenza, viene aggiunto alla soluzione dell’analita. Poiché il cambiamento di colore è vicino ma non esattamente al punto di equivalenza, il punto in cui si verifica il cambiamento di colore è chiamato punto finale. Gli indicatori sono scelti in modo che il punto finale sia molto vicino al punto di equivalenza. È importante mantenere una titolazione ben mescolata, in modo che il titolante e l’analita possano entrare in contatto tra loro e reagire rapidamente. Si può usare sia l’agitazione manuale della beuta che l’agitazione meccanica. In questo esperimento userai l’agitazione manuale. Il tipo più comune di titolazione è la titolazione acido-base. In questo esperimento, determinerai la concentrazione dell’acido acetico, HC2H3O2 nell’aceto commerciale. In questa titolazione, NaOH acquoso è il titolante e l’aceto è l’analita. Assumiamo che la base forte e l’acido debole reagiscano completamente secondo l’equazione netta:
L’equazione bilanciata mostra una stechiometria 1:1, quindi possiamo scrivere:
O più generalmente:
Le moli di base possono essere calcolate dalla molarità per il volume
Come promemoria sulle unità di concentrazione, la molarità è definita come il numero di moli di soluto in un litro di soluzione (M = mol/L). Questo è numericamente uguale al numero di millimoli di soluto in un millilitro di soluzione (M = mmol/mL). È spesso conveniente usare questa seconda definizione di molarità nelle titolazioni e in altri lavori dove sono coinvolte piccole quantità. Ci sono 1000 mmol in 1 mol e 1000 mL in 1 litro. Per esempio, 10,2 mL di soluzione 0,100 M NaOH contiene 1,02 mmol di NaOH.
0.100 mmol NaOH
1 mol soluzione
= 1,02 mmol NaOH
La molarità dell’acido può essere calcolata dalle moli divise per il volume
In questo esperimento, un volume accuratamente misurato di aceto
viene messo in una beuta e la massa viene determinata. Il campione di aceto viene poi titolato con una soluzione di NaOH di concentrazione nota
e si determina il volume di soluzione di NaOH necessario per raggiungere il punto finale
.
e
sono tutti noti, quindi la concentrazione dell’acido
può essere determinata come descritto sopra. Inoltre, la massa di acido acetico nel campione può essere determinata dal numero di moli presenti e dalla massa molare dell’acido acetico
Infine, la massa percentuale di acido acetico nell’aceto può essere determinata dalla massa dell’acido acetico nel campione e dalla massa della soluzione di aceto che è stata titolata.
massa di acido acetico nel campione
massa della soluzione di aceto titolata
× 100
Nella titolazione dell’acido acetico con NaOH acquoso, la fenolftaleina viene usata come indicatore. La fenolftaleina è quasi incolore in soluzione acida ma diventa rosa a un pH di circa 8. Questo indica che la base ha neutralizzato tutto l’acido. Mentre si titola l’aceto, si osserverà che il colore rosa è più persistente man mano che si aggiunge più base. Questo è un segnale per rallentare l’aggiunta di base e controllarla attentamente. Il punto finale è stato raggiunto quando un debole colore rosa persiste per almeno 30 secondi. È facile superare il punto finale. Se questo accade, si avrà una soluzione rosa-viola scuro, e si dovrà ripetere la titolazione, quindi fate attenzione. Nota il volume che hai usato, fermati al di sotto di questo volume nelle titolazioni successive, e aggiungi l’ultimo millilitro o giù di lì a goccia. Il tuo istruttore ti mostrerà come controllare il rubinetto della buretta per facilitare questa operazione. Nota che le misure di volume nelle titolazioni sono di solito riportate con quattro cifre significative, quindi anche le concentrazioni sono di solito riportate con quattro cifre significative. Fai attenzione a questo nel tuo lavoro; quando calcoli le masse molari, assicurati di avere quattro cifre significative.
Obiettivi
Completando questa indagine potrai:
-
1
Standardizzare una soluzione di NaOH(aq).
-
2
Titolare un campione di aceto con la soluzione standardizzata di NaOH(aq).
-
3
Misurare la densità di un campione di aceto.
-
4
Calcolare la molarità e la percentuale di massa dell’acido acetico nel campione di aceto.
Materiali disponibili per l’uso
- Aceto
- Soluzione di NaOH(aq)
- KHP – idrogeno ftalato di potassio
- Indicatore di fenolftaleina
- Pipette da 10 mL
- Beaker
- Flaconi Erlenmeyer, 125 mL
- Supporto per buretta con buretta
- Funnel
- Bilance analitiche
Precauzioni di sicurezza
Il NaOH è corrosivo. Può attaccare la pelle e causare danni permanenti agli occhi. Se la soluzione di NaOH ti schizza negli occhi, usa immediatamente la stazione di lavaggio oculare. Tenere gli occhi aperti e sciacquare con acqua. Se si verifica un contatto con la pelle o i vestiti, sciacquare l’area interessata con acqua. Chiedi al tuo compagno di laboratorio di informare il tuo istruttore della fuoriuscita.
Inizio
Il tuo primo compito è standardizzare la soluzione di NaOH usando il KHP solido (KC8H5O4, 204,22 g/mol). Questo significa che devi determinare la sua molarità con almeno tre cifre significative. Avrai bisogno di almeno tre titolazioni che concordino entro l’1% come descritto nella procedura. Hai altri due compiti da svolgere in laboratorio. Devi determinare la densità della soluzione di aceto e la molarità dell’acido acetico nell’aceto. La percentuale di massa dell’acido acetico può essere calcolata dai tuoi dati. Per portare a termine i tuoi compiti, dovrai effettuare misure di volume e di massa molto accurate. Burette e pipette sono utili per misurare accuratamente i volumi. La buretta e la pipetta sono descritte nell’introduzione e nei video. Prima di iniziare, assicurati di aver capito il loro uso corretto.
Procedura
Per favore stampa il foglio di lavoro per questo laboratorio. Avrai bisogno di questo foglio per registrare i tuoi dati.

Preparazione della buretta
Controlla la buretta sciacquando i lati con una bottiglia di acqua distillata per verificare se l’acqua “sfoglia” l’interno della buretta. Se si osservano gocce d’acqua, la buretta deve essere lavata prima dell’uso. Fare attenzione a non graffiare la superficie interna se si ritiene necessario utilizzare una spazzola per burette per pulirla. Sciacquare bene la buretta con acqua di rubinetto, compreso il rubinetto e le rondelle. Poi sciacquare le pareti della buretta con acqua deionizzata/distillata.
Infine sciacquare la buretta almeno DUE volte con piccole porzioni della vostra soluzione di NaOH per assicurarsi che tutta l’acqua sia stata rimossa. Far uscire la soluzione attraverso la punta.
Riempire la buretta con la soluzione di NaOH usando un imbuto.
Per rimuovere le bolle d’aria intrappolate nella punta della buretta dopo il riempimento, aprire e chiudere velocemente il rubinetto diverse volte. Nota: Se il rubinetto si allinea correttamente con la punta della buretta, le bolle intrappolate non sono così prevalenti. Controlla con l’istruttore se la bolla persiste.
Standardizzazione con KHP
Usa ~1 grammo di KHP. REGISTRARE IMMEDIATAMENTE LA MASSA NEL GRAFICO DEI DATI.
Usa la bottiglia di lavaggio con acqua distillata per assicurarti che tutti i campioni siano stati trasferiti nella beuta.
Aggiungi circa 50 mL di acqua distillata e due o tre gocce di indicatore. L’indicatore fenolftaleina sarà usato in questo esperimento di titolazione. Non usare troppo indicatore o titolerai anche quella molecola. Sii coerente nell’usare lo stesso numero di gocce in tutti i campioni.
Tecnica di titolazione
Metti un foglio di carta bianca sotto la beuta di raccolta per osservare più facilmente il punto finale.
Usare una carta bianca superiore e nera inferiore per facilitare la lettura del menisco. Posizionando la carta dietro la buretta e la linea nera appena sotto il menisco, il menisco si scurisce per facilitare la lettura. Registrare il volume iniziale della soluzione di NaOH al centesimo millilitro più vicino (±0,01 mL) nella tabella dei dati del tuo quaderno.
Il titolante (soluzione di NaOH nella buretta) può essere aggiunto abbastanza velocemente all’inizio, ma man mano che ci si avvicina al punto finale, il ritmo di aggiunta dovrebbe essere rallentato. Se si è destrimani, è più veloce aggiungere il titolante con la mano sinistra mentre si agita con la destra (viceversa per i mancini). Man mano che si avvicina il punto finale, il colore rosa persisterà sempre più a lungo. In prossimità del punto finale, sciacquare le pareti della beuta con acqua distillata per assicurarsi che tutta la base NaOH aggiunta abbia reagito.
Quando si è molto vicini al punto finale, sospendere una mezza goccia di base sulla punta della buretta e sciacquare la goccia nel matraccio ricevente con la bottiglia di acqua distillata. Un altro metodo usato per aggiungere una frazione di goccia è quello di ruotare il rubinetto di arresto di 180 gradi molto rapidamente; tuttavia, si può inavvertitamente aggiungere troppa base se si esegue questa tecnica in modo errato.
Il punto finale si verifica quando la fenolftaleina passa da trasparente al più debole colore rosa che si possa vedere e persiste per un minimo di 30 secondi. Registrare il volume finale della soluzione di NaOH al centesimo millilitro più vicino (±0,01 mL) nella tabella dei dati. Determinare quindi la quantità di soluzione di NaOH utilizzata nella titolazione.
Il tuo gruppo deve completare un MINIMO di QUATTRO PROVE e tre prove devono concordare entro il ±1%. In realtà si può fare di più, a seconda della vostra tecnica. NON PUOI SEMPLICEMENTE “CANCELLARE” I DATI PERCHÉ NON TI PIACCIONO; DEVI INDICARE IL MOTIVO DELLO SCARTO. La ragione può essere ovvia come “overran endpoint” o si può essere in grado di scartare il valore solo sulla base di test statistici.
Molarità dell’acido acetico nell’aceto
Condiziona la buretta con NaOH standardizzato della settimana precedente.
Condiziona una pipetta da 10 mL con la soluzione di aceto.
Misura 10 mL di aceto in una beuta e aggiungi l’indicatore fenolftaleina.
Titola con il NaOH standard del laboratorio precedente.
Sessione poster interattiva
Una volta che il tuo gruppo ha completato il lavoro, prepara una lavagna bianca che puoi usare per condividere e giustificare le tue idee. Vedi l’opuscolo fornito per i dettagli su questo processo.
Rapporto
Una volta che hai completato la tua ricerca, dovrai preparare un rapporto di indagine che consiste in tre sezioni. Questo rapporto può richiedere più di due pagine con tabelle di dati. Questo rapporto deve essere dattiloscritto e qualsiasi diagramma, figura o tabella deve essere incorporato nel documento.
- Sezione 1: Su quale concetto e/o tecnica hai indagato e come si collega alla domanda guida? Quali fattori determinano l’accuratezza e la precisione con cui si può determinare la concentrazione di acido acetico nell’aceto? Descrivi la titolazione e il suo uso insieme alla stechiometria molare per determinare la concentrazione.
- Sezione 2: Come hai svolto il tuo lavoro e perché hai condotto la tua indagine in questo modo? In particolare, quali misure hai preso per assicurare l’accuratezza e la precisione?
- Sezione 3: L’argomento di questa indagine non è tanto il tuo risultato quanto la validità e l’affidabilità dei tuoi dati. Questa relazione dovrebbe includere una tabella di dati completa simile a quella che hai usato nell’esercizio precedente al laboratorio dove hai trovato la molarità della tua base. Non riportare il processo di standardizzazione della base, se non per riportare la molarità di NaOH con la deviazione standard. Dovete fornire una giustificazione per aver scartato qualsiasi prova di titolazione con l’aceto. Dovreste mostrare un calcolo completo della molarità e della massa % dell’aceto. La vostra risposta finale per la molarità dell’aceto dovrebbe includere una deviazione standard.
- Questa terza sezione è dove non solo presentate i vostri dati, ma usate i valori ottenuti come prova nel vostro ragionamento. Affermazioni come “vedi la tabella dei dati per i valori” non sono accettabili!