Hoofdverschil – Elektronengeometrie vs Moleculaire Geometrie
De geometrie van een molecule bepaalt de reactiviteit, polariteit en biologische activiteit van die molecule. De geometrie van een molecuul kan zowel de elektronengeometrie als de moleculaire geometrie zijn. De VSEPR-theorie (Valence Shell Electron Pair Repulsion theory) kan worden gebruikt om de geometrie van moleculen te bepalen. De elektronengeometrie omvat de eenzame elektronenparen die in een molecuul aanwezig zijn. De moleculaire geometrie kan worden bepaald door het aantal bindingen dat een bepaald molecuul heeft. Het belangrijkste verschil tussen elektronengeometrie en moleculaire geometrie is dat elektronengeometrie wordt gevonden door zowel de eenzame elektronenparen als de bindingen in een molecuul te nemen, terwijl moleculaire geometrie wordt gevonden door alleen de bindingen in het molecuul te nemen.
Belichte gebieden
1. Wat is Elektronengeometrie
– Definitie, Identificatie, Voorbeelden
2. Wat is Moleculaire Geometrie
– Definitie, Identificatie, Voorbeelden
3. Wat zijn Geometrieën van Moleculen
– Verklarende Grafiek
4. Wat is het Verschil Tussen Elektronengeometrie en Moleculaire Geometrie
– Vergelijking van de Belangrijkste Verschillen
Key Terms: Elektronengeometrie, Eenzaam elektronenpaar, Moleculaire Geometrie, VSEPR-theorie

Wat is elektronengeometrie
Elektronengeometrie is de vorm van een molecuul die wordt voorspeld door rekening te houden met zowel bindingselektronenparen als lone elektronenparen. De VSEPR-theorie stelt dat elektronenparen die zich rond een bepaald atoom bevinden, elkaar afstoten. Deze elektronenparen kunnen zowel bindingselektronen als niet-bindingselektronen zijn.
De elektronengeometrie geeft de ruimtelijke rangschikking van alle bindingen en lone paren van een molecuul. De elektronengeometrie kan worden verkregen met behulp van de VSEPR-theorie.
Hoe bepaal je de elektronengeometrie
De volgende stappen worden bij deze bepaling gebruikt.
- Voorspel het centrale atoom van het molecuul. Het moet het meest elektronegatieve atoom zijn.
- Bepaal het aantal valentie-elektronen in het centrale atoom.
- Bepaal het aantal elektronen dat door andere atomen wordt afgestaan.
- Bereken het totale aantal elektronen rond het centrale atoom.
- Deel dat aantal van 2. Dit geeft het aantal aanwezige elektrongroepen.
- Verreken het aantal aanwezige enkelvoudige bindingen rond het centrale atoom met het hierboven verkregen sterische getal. Dit geeft het aantal alleenstaande elektronenparen dat in het molecuul aanwezig is.
- Bepaal de elektronengeometrie.
Voorbeelden
Elektronengeometrie van CH4
Centraal atoom van het molecuul = C
Aantal valentie-elektronen van C = 4
Aantal elektronen afgestaan door waterstofatomen = 4 x (H)
= 4 x 1 = 4
Totaal aantal elektronen rond C = 4 + 4 = 8
Aantal elektrongroepen = 8 / 2 = 4
Aantal aanwezige enkelvoudige bindingen = 4
Aantal eenzame elektronenparen = 4 – 4 = 0
Daarom, de elektronengeometrie = tetrahedraal
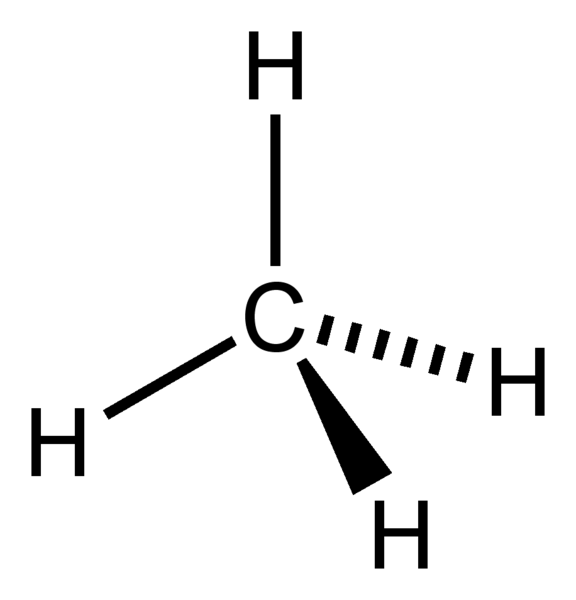
Figuur 1: Elektronengeometrie van CH4
Elektronengeometrie van ammoniak (NH3)
Centrale atoom van het molecuul = N
Aantal valentie-elektronen van N = 5
Aantal elektronen afgestaan door waterstofatomen = 3 x (H)
= 3 x 1 = 3
Totaal aantal elektronen rond N = 5 + 3 = 8
Aantal elektrongroepen = 8 / 2 = 4
Aantal aanwezige enkelvoudige bindingen = 3
Aantal eenzame elektronenparen = 4 – 3 = 1
Daaruit volgt, de elektronengeometrie = tetrahedraal
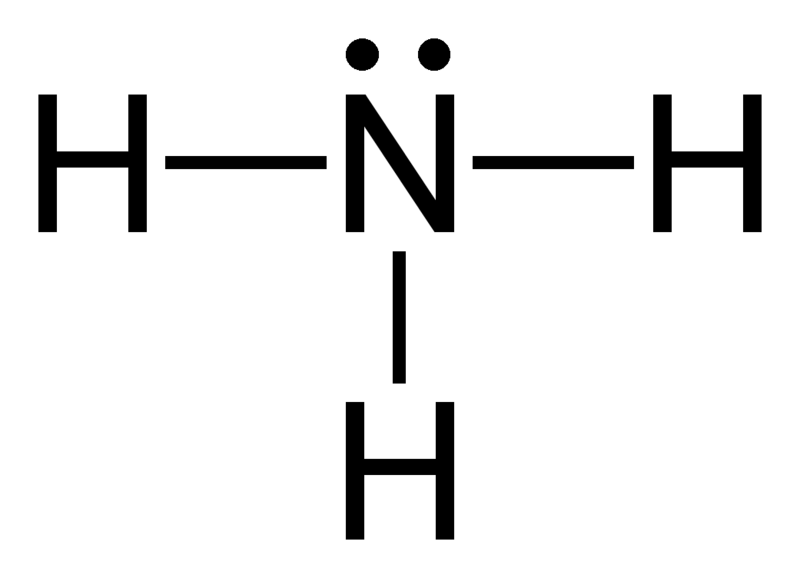
Figuur 2: Elektronengeometrie van ammoniak
Elektronengeometrie van AlCl3
Centrale atoom van het molecuul = Al
Aantal valentie-elektronen van Al = 3
Aantal elektronen afgestaan door Cl-atomen = 3 x (Cl)
= 3 x 1 = 3
Totaal aantal elektronen rond N = 3 + 3 = 6
Aantal elektrongroepen = 6 / 2 = 3
Aantal aanwezige enkelvoudige bindingen = 3
Aantal eenzame elektronenparen = 3 – 3 = 0
Daaruit volgt, de elektronengeometrie = trigonaal vlak

Figuur 3: Elektronengeometrie van AlCl3
Soms zijn de elektronengeometrie en de moleculaire geometrie hetzelfde. Dat komt omdat alleen bindingselektronen in aanmerking worden genomen bij de bepaling van de geometrie bij afwezigheid van eenzame elektronenparen.
Wat is moleculaire geometrie
Moleculaire geometrie is de vorm van een molecuul die wordt voorspeld door alleen bindingselektronenparen in aanmerking te nemen. In dit geval wordt geen rekening gehouden met lone elektronenparen. Bovendien worden dubbele bindingen en drievoudige bindingen beschouwd als enkelvoudige bindingen. De geometrieën worden bepaald op basis van het feit dat eenzame elektronenparen meer ruimte nodig hebben dan bindende elektronenparen. Als een bepaald molecuul bijvoorbeeld is samengesteld uit twee paren bindende elektronen samen met een lone paar, is de moleculaire geometrie niet lineair. De geometrie is daar “gebogen of hoekig” omdat het lone elektronenpaar meer ruimte nodig heeft dan twee bindingselektronenparen.
Voorbeelden van moleculaire geometrie
Moleculaire geometrie van H2O
Centrale atoom van het molecuul = O
Aantal valentie-elektronen van O = 6
Aantal elektronen afgestaan door waterstofatomen = 2 x (H)
= 2 x 1 = 2
Totaal aantal elektronen rond N = 6 + 2 = 8
Aantal elektrongroepen = 8 / 2 = 4
Aantal eenzame elektronenparen = 2
Aantal aanwezige enkelvoudige bindingen = 4 – 2 = 2
Daaruit volgt, elektronengeometrie = Bent
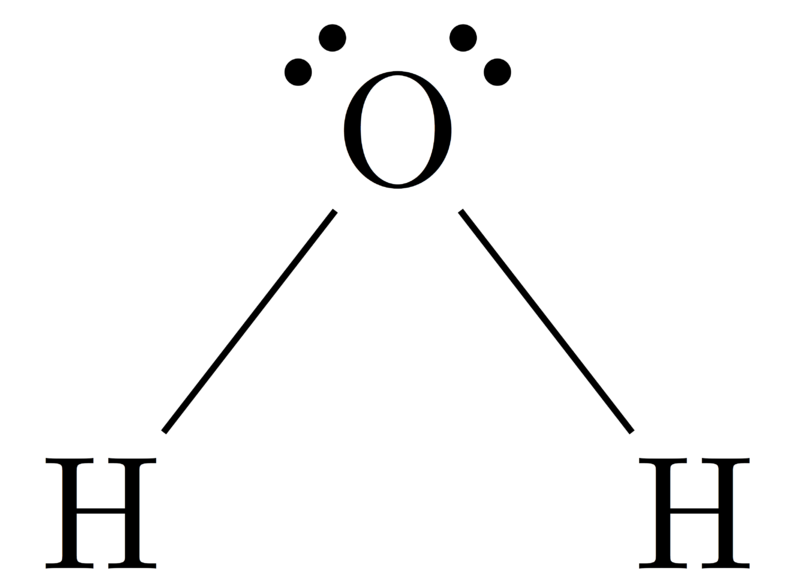
Figuur 4: Moleculaire geometrie van H2O
Moleculaire geometrie van ammoniak (NH3)
Centrale atoom van het molecuul = N
Aantal valentie-elektronen van N = 5
Aantal elektronen afgestaan door waterstofatomen = 3 x (H)
= 3 x 1 = 3
Totaal aantal elektronen rond N = 5 + 3 = 8
Aantal elektrongroepen = 8 / 2 = 4
Aantal eenzame elektronenparen = 1
Aantal aanwezige enkelvoudige bindingen = 4 – 1 = 3
Daaruit volgt, elektronengeometrie = trigonale piramide
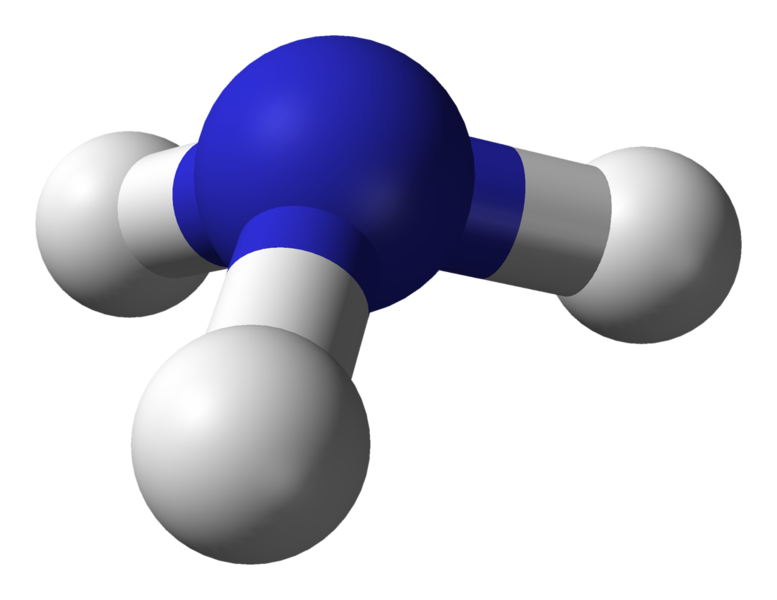
Figuur 5: Kogel- en staafstructuur voor ammoniakmolecuul
De elektronengeometrie van ammoniak is tetrahedraal. Maar de moleculaire geometrie van ammoniak is trigonale piramide.
Geometrie van Moleculen
De volgende grafiek toont enkele geometrieën van moleculen volgens het aantal aanwezige elektronenparen.
|
Aantal elektronenparen |
Aantal bindingselektronenparen paren |
Aantal alleenstaande elektronenparen |
Elektronengeometrie |
Moleculaire geometrie |
|
|
Lineair |
Lineair |
||||
|
Trigonaal planair |
Trigonaal planair |
||||
|
Trigonaal planair |
Gebogen |
||||
|
Tetrahedraal |
Tetrahedraal |
||||
|
Tetrahedraal |
Trigonale piramide |
||||
| Tetrahedral |
Bent |
||||
|
Trigonaal bypyramidaal |
Trigonaal bypyramidaal |
||||
|
Trigonaal bypyramidaal |
Seesaw |
||||
|
Trigonaal bypyramidaal |
T-vormig |
||||
|
Trigonaal bypyramidaal |
Lineair |
||||
|
Octahedral |
Octahedraal |
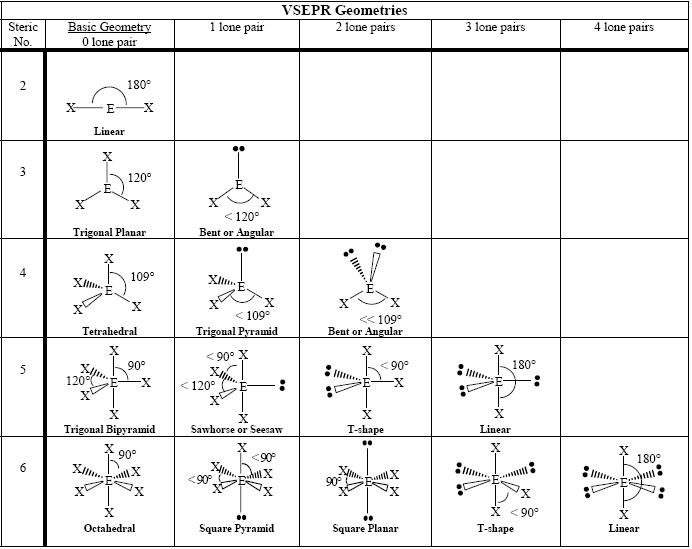
Figuur 6: Basisgeometrieën van moleculen
De bovenstaande tabel toont de basisgeometrieën van moleculen. De eerste kolom van geometrieën toont elektronengeometrieën. Andere kolommen tonen moleculaire geometrieën, waaronder de eerste kolom.
Verschil tussen Elektronengeometrie en Moleculaire Geometrie
Definitie
Elektronengeometrie: Elektronengeometrie is de vorm van een molecuul die wordt voorspeld door rekening te houden met zowel bindingselektronenparen als alleenstaande elektronenparen.
Moleculaire Geometrie: Moleculaire geometrie is de vorm van een molecuul die wordt voorspeld door alleen bindingselektronenparen te beschouwen.
Lone Electron Pairs
Electron Geometrie: Alleenstaande elektronenparen worden in aanmerking genomen bij het vinden van de elektronengeometrie.
Moleculaire Geometrie: Bij het vinden van de moleculaire geometrie wordt geen rekening gehouden met alleenstaande elektronenparen.
Aantal elektronenparen
Elektronengeometrie: Het aantal totale elektronenparen moet worden berekend om de elektronengeometrie te vinden.
Moleculaire Geometrie: Het aantal bindende elektronenparen moet worden berekend om de moleculaire geometrie te vinden.
Conclusie
Elektronengeometrie en moleculaire geometrie zijn hetzelfde als er geen eenzame elektronenparen op het centrale atoom zijn. Maar als er wel eenzame elektronenparen op het centrale atoom zijn, wijkt de elektronengeometrie altijd af van de moleculaire geometrie. Daarom hangt het verschil tussen elektronengeometrie en moleculaire geometrie af van de aanwezigheid van eenzame elektronenparen in een molecuul.
1. “Moleculaire geometrie”. N.p., n.d. Web. Hier beschikbaar. 27 juli 2017.
2. “VSEPR theorie.” Wikipedia. Wikimedia Foundation, 24 juli 2017. Web. Hier beschikbaar. 27 juli 2017.
Image Courtesy:
1. “Methane-2D-small” (Public Domain) via Commons Wikimedia
2. “Ammonia-2D-flat” Door Benjah-bmm27 – Eigen werk (Public Domain) via Commons Wikimedia
3. “AlCl3” Door Dailly Anthony – Eigen werk (CC BY-SA 3.0) via Commons Wikimedia
4. “H2O Lewis Structure PNG” Door Daviewales – Eigen werk (CC BY-SA 4.0) via Commons Wikimedia
5. “Ammonia-3D-balls-A” Door Ben Mills – Eigen werk (Public Domain) via Commons Wikimedia
6. “VSEPR geometries” Door Dr. Regina Frey, Washington University in St. Louis – Eigen werk, Public Domain) via Commons Wikimedia
![]()