1. Morfologia
2. Funkcje
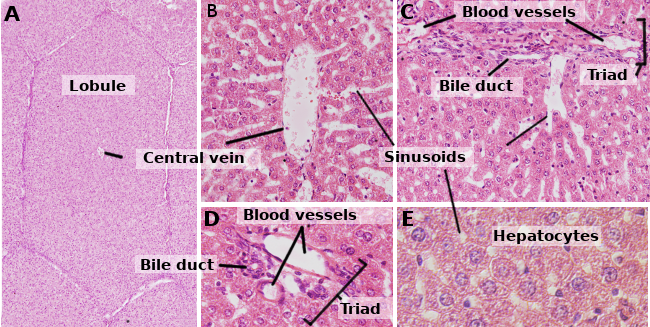
Hepatocyty to komórki wątroby, stanowiące około 80 % tego narządu. Zorganizowane są w arkusze o grubości około jednej komórki. Blaszki są połączone między sobą tworząc strukturę gąbczastą (ryc. 1 i 2). Hepatocyty są komórkami dość długowiecznymi, odnawiającymi się co około 5 miesięcy. Może się to jednak zmienić pod wpływem procesów regeneracyjnych, w których hepatocyty wykazują dużą zdolność do proliferacji i regeneracji uszkodzonej tkanki wątroby.

Morfologia
Hepatocyty są komórkami poliedralnymi, to znaczy, że mają kilka twarzy. Zwykle wykazują 6 twarzy, ale liczba ta może być różna. Twarze stykają się albo z innym hepatocytem, albo z sinusoidą (ryc. 3). Hepatocyty są dużymi komórkami, o średnicy około 20-30 µm. Posiadają okrągłe jądro skupione w cytoplazmie. Jednak w wątrobie dorosłego człowieka do 25% hepatocytów może być dwujądrzaste (Rycina 2). Większość jąder jest tetraploidalna, a więc zawiera podwójną ilość DNA niż zwykła komórka. Wielkość jąder jest zmienna, choć są one większe w komórkach tetraploidalnych. Jądra wykazują rozproszoną heterochromatynę i jedno lub więcej nukleoli. W warunkach prawidłowych nieczęsto można zaobserwować hepatocyty mitotyczne (1 na 10000 lub 20000 hepatocytów). Mitotyczne hepatocyty zwiększają się jednak znacznie w przypadku urazów wątroby i procesów regeneracyjnych. Cechy cytoplazmy zmieniają się w zależności od stanu fizjologicznego komórki, na co największy wpływ mają zapasy tłuszczu i glikogenu. W hepatocycie znajduje się wiele małych mitochondriów, od 800 do 100 na hepatocyt. Szacuje się, że jeden hepatocyt może zawierać około 50 aparatów Golgiego, które są zwykle zorganizowane w stosy od 3 do 5 cystern z pogrubionymi obszarami bocznymi zawierającymi ciemne ciała. Stosy cystern s± w pewnym sensie rozproszone w cytoplazmie, chociaż często obserwuje się je w pobliżu kanalików bilateralnych (ryc. 3 i 4). Hepatocyty zawierają wiele peroksysomów (200 do 300), więcej niż inne prawidłowe komórki. W pobliżu kanalików kęsowatych znajdują się również liczne lizosomy.


W cytoplazmie hepatocytów znajdują się obfite pokłady glikogenu i lipidów (ziarnisty wygląd hepatocytów po barwieniu hematoksyliną i eozyną jest spowodowany otworami pozostawionymi przez ekstrakcję lipidów z cytoplazmy podczas obróbki tkanki). W cytoplazmie widoczne są również ciałka szczątkowe zawierające lipofuscynę. Retikulum endoplazmatyczne gładkie jest dość obfite, choć wielkość organelli zmienia się w zależności od aktywności metabolicznej hepatocytu. Jest ono skoncentrowane wokół magazynów glikogenu. W zrazikach wątroby, porównując hepatocyty obwodowe i centralne, można zauważyć różnice morfologiczne, uwarunkowane głównie cechami krwi. Na przykład hepatocyty obwodowe po trawieniu jako pierwsze magazynują glikogen, ale jako ostatnie przemieszczają go, gdy reszta ciała go potrzebuje. Natomiast magazynowanie tłuszczu następuje najpierw w centralnie położonych hepatocytach, które zazwyczaj mają bardziej gładkie retikulum endoplazmatyczne. Z drugiej strony, szorstkie retikulum endoplazmatyczne ma o 50% większą powierzchnię w obwodowych i średnio położonych hepatocytach niż w hepatocytach znajdujących się w wewnętrznej części zrazika wątroby.
W przeciwieństwie do innych komórek nabłonkowych, hepatocyty nie są związane z błoną podstawną. Ich błona podstawna otoczona jest macierzą zewnątrzkomórkową o małej gęstości, syntetyzowaną przez same hepatocyty. Ułatwia ona dyfuzję i wymianę cząsteczek z zatokami przez przestrzeń Disse’a, czyli przestrzenie okołopęcherzykowe, które są przestrzenią pomiędzy śródbłonkiem fenestrującym a hepatocytami. W tej macierzy zewnątrzkomórkowej brak jest lamininy, przynajmniej w okresie różnicowania się hepatocytów. Natomiast kolagen typu IV i fibronektyna wyglądają na niezbędne do prawidłowego różnicowania się hepatocytów. Hepatocyty są połączone między sobą przez połączenia szczelinowe, połączenia adherentne, desmosomy i połączenia ścisłe.
Hepatocyty są komórkami spolaryzowanymi, to znaczy, że istnieją różnice pomiędzy regionami zwróconymi w stronę kanalików żółciowych a regionami znajdującymi się w pobliżu zatok. Polaryzacja jest niezbędna do prawidłowego funkcjonowania hepatocytu, a w wielu patologiach wątroby ulega zaburzeniu. Region apikalny jest w kontakcie z kanalikami żółciowymi. Podobnie jak w domenie apikalnej komórek nabłonkowych, znajdują się tu połączenia ścisłe, które uszczelniają i utrzymują integralność kanalików żółciowych. Błona apikalna ulega pofałdowaniu w mikrowypustki, które znacznie zwiększają powierzchnię błony. Błona wierzchołkowa stanowi około 13 % całej błony hepatocytów i może zawierać dużą ilość cząsteczek. Usunięcie połączeń ścisłych prowadzi do dezorganizacji polarności komórek. Polarność hepatocytów i kanały żółciowe powstają w okresie rozwoju embrionalnego.
Funkcjonalna biegunowość opiera się na nierównomiernym rozmieszczeniu transporterów i innych cząsteczek błonowych pomiędzy apikalnymi i bazo-lateralnymi domenami błony plazmatycznej. Transportery ABC (ATP binding cassettes) są jednymi z najważniejszych transporterów apikalnych w hepatocytach. Aparat Golgiego, endosomy i cytoszkielet (mikrotubule i filamenty aktynowe) są odpowiedzialne za zróżnicowaną dystrybucję cząsteczek pomiędzy tymi dwoma domenami błonowymi. Istnieją dwie drogi dostarczania białek do domeny apikalnej (Ryc. 5): z aparatu Golgiego białka (np. transportery ABC) są uwalniane w pęcherzykach w kierunku apikalnej błony plazmatycznej lub w kierunku endosomów recyklingowych, które pełnią funkcję pośredników. Inne białka podążają szlakiem transcytozy, wędrując najpierw do błon podstawnych, a następnie są zamykane w pęcherzykach endocytotycznych w kierunku endosomów, gdzie ponownie są pakowane w pęcherzyki i transportowane do błony apikalnej. Rzadszy jest szlak obejmujący egzocytozę lizosomów, po której następują transportery bednarki.

Funkcje
Główną funkcją hepatocytów jest metabolizowanie substancji pochodzących z trawienia. Wątroba jest nawadniana przez żyłę wrotną, która gromadzi cząsteczki powstałe w wyniku trawienia w jelicie. Hepatocyty są również silnie zaangażowane w detoksykację potencjalnie szkodliwych cząsteczek. Z drugiej strony, hepatocyty syntetyzują żółć, która jest ostatecznie uwalniana do jelita i pomaga w trawieniu. Dla obu funkcji, metabolizowania molekuł pochodzących z trawienia i uwalniania żółci, hepatocyty znajdują się w uprzywilejowanym miejscu: w kontakcie z zatokami, które doprowadzają strawione molekuły do jelita, i tworzą kanały żółciowe, które odprowadzają żółć z zrazików wątroby.
Poziom glukozy. Hepatocyty pobierają cząsteczki glukozy pochodzące z trawienia i przechowują je w postaci glikogenu, który jest mobilizowany, gdy organizm potrzebuje energii. Glikogen jest powszechnie spotykany w pobliżu retikulum endoplazmatycznego, ponieważ enzym glukozo-6-fosfataza znajduje się w tym organelle. Glukozo-6-fosfataza katalizuje glukozo-6-fosforan, formę molekularną glukozy po katabolizmie glikogenu, i wytwarza wolną glukozę, która może opuścić hepatocyt i dotrzeć do krwiobiegu.
Synteza cząsteczek. Sole żółciowe, które pomagają w trawieniu tłuszczów, są jedną z substancji syntetyzowanych przez hepatocyty. W gładkim retikulum endoplazmatycznym znajduje się wiele enzymów biorących udział w syntezie cholesterolu i innych lipidów. Ponadto, hepatocyty wytwarzają lipoproteiny potrzebne do transportu lipidów w krwiobiegu. Również fibrynogen służący do krzepnięcia krwi oraz albuminy osocza są syntetyzowane przez hepatocyty. W wątrobie, jako produkt uboczny degradacji białek, wytwarzany jest mocznik. Produkcja i nagromadzenie dużej ilości mocznika w organizmie może być szkodliwe. Hepatocyty magazynują witaminę A i B oraz heparynę.
Metabolizm lipidów. Beta-oksydacja, biorąca udział w katabolizmie lipidów, działa w licznych peroksysomach hepatocytów.
Detoksykacja. Hepatocyty gromadzą substancje odżywcze pochodzące z trawienia, ale również jako pierwsze otrzymują substancje potencjalnie toksyczne. Etanol z napojów alkoholowych jest rozkładany głównie w wątrobie, a właściwie w licznych peroksysomach hepatocytów. W tych organellach połowa spożytego alkoholu jest przekształcana w aldehyd octowy. W retikulum endoplazmatycznym gładkim znajdują się enzymy biorące udział w degradacji lub inaktywacji toksyn i leków. W okresach wysokiego zapotrzebowania na usuwanie substancji toksycznych, np. podczas leczenia farmakologicznego lub ciągłego picia alkoholu, siateczka endoplazmatyczna może stać się najbardziej obszerną organellą hepatocytu. Leki są zazwyczaj inaktywowane poprzez łączenie się z innymi cząsteczkami. Na przykład glukozylotransferaza sprzęga cząsteczki z barbituranami.
Magazynowanie i regulacja żelaza. Hepatocyty mogą pracować w celu magazynowania żelaza, które jest skoncentrowane w cytoplazmatycznych depozytach związanych z ferrytyną. Hepatocyty mogą wychwytywać żelazo na kilka sposobów: związane z transferyną, jako część grup hemowych oraz z grup niehemowych. Żelazo związane z transferyną dostaje się do komórki przez endocytozę pośredniczoną przez receptor TRF1. Kiedy pęcherzyki endocytarne łączą się z endosomami, transferyna uwalnia Fe3+, który jest przekształcany w F2+, a następnie wyrzucany do cytozolu przez transporter DMT1 (divalent metal transporter 1). Cz±steczki żelaza hemowego s± również endocytowane i translokowane do cytozolu przez błonę endosomaln± za pomoc± transportera HRG1. Większość żelaza dostaje się jednak z przestrzeni zewnątrzkomórkowej przez transporter ZIP14 umieszczony w błonie plazmatycznej hepatocytów, zwrócony w stronę zatok. Po dostaniu się do cytozolu żelazo jest wiązane z ferrytyną i magazynowane w cytoplazmie, ponieważ wolne żelazo jest toksyczne. Uwalnianie żelaza z enterocytu jest pośredniczone przez transporter ferroportyny znajdujący się w błonie plazmatycznej w pobliżu sinusoid.
Po szpiku kostnym, wątroba jest drugim głównym ośrodkiem produkcji grup hemowych. Grupa hemowa jest grupą prostetyczną (niepeptydową) obecną w wielu białkach służących do transportu tlenu, w enzymach takich jak katalazy i peroksydazy, które chronią przed substancjami utleniającymi. Wchodzi również w skład cytochromów mitochondrialnych i peroksysomalnych. Większa ilość grup hemowych znajduje się w hemoglobinie, które są syntetyzowane w szpiku kostnym. W wątrobie synteza grup hemowych zależy od ilości mikrosomalnego cytochromu p450 potrzebnego komórce, tak więc większość tych grup hemowych wchodzi w skład cytochromów p450.
Hepatocyty uwalniają hormon hepcidin, który reguluje ogólnoustrojowe stężenie żelaza w organizmie. Hormon ten kontroluje ilość żelaza w osoczu poprzez sprzyjanie internalizacji i degradacji ferroportyny, transportera żelaza występującego w enterocytach, makrofagach i hapatocytach. Usunięcie ferroportyny hamuje uwalnianie żelaza z tych komórek. Synteza hepcydyny jest regulowana przez stężenie transferyny z żelazem w osoczu, przez magazyny żelaza w hepatocytach oraz przez stan zapalny. Aktywność erytropoetyczna hamuje uwalnianie hepcydyny.
Bibliografia
Gissen P, Arias IM. 2015. Strukturalna i funkcjonalna polarność hepatocytów a choroby wątroby. Journal of hepatholoty. 63: 1023-1037.
Knutson MD. 2014. Dorosłe jelitowe komórki macierzyste: krytyczne sterowniki homeostazy i regeneracji nabłonka. Nature review in molecular cell biology. 15:19-33.
Weiss L, Greep RO. 1982. Histología. 4ªedición. Editorial el Ateneo. Barcelona.