Pytanie prowadzące
Jakie czynniki decydują o tym, jak dokładnie i precyzyjnie można określić stężenie kwasu octowego w occie?
Wprowadzenie
Wiele laboratoriów analizuje produkty konsumenckie w celu określenia dokładności etykietowania produktu. Bardzo powszechna i prosta technika miareczkowania jest zademonstrowana w tym eksperymencie. Miareczkowanie jest procedurą analityczną, w której reakcja przebiega w dokładnie kontrolowanych warunkach. Mierzy się stechiometryczną objętość jednego reagentu o znanym stężeniu, titranta, która jest wymagana do reakcji z innym reagentem o nieznanym stężeniu, analitem. Stężenie analitu jest określane na podstawie stężenia i objętości titranta oraz stechiometrii reakcji między nimi. Układ doświadczalny jest przedstawiony na rysunku 1. Biureta, która zawiera titrant, jest skalibrowana tak, aby objętość roztworu, którą dostarcza, mogła być określona z dużą dokładnością i precyzją. Titrant dodaje się do analitu do momentu dodania stechiometrycznej objętości titranta. Nazywa się to punktem równoważności, w którym odczytuje się objętość titranta dostarczonego przez biuretę. Zazwyczaj odczyty objętości są szacowane z dokładnością do 0,01 mL. Dostarczanie titranta reguluje się za pomocą korka na biurecie. W miarę nabrania wprawy można dozować ułamki kropli titranta i kontrolować procedurę na tyle dobrze, że powtórzone miareczkowania będą się zgadzać w granicach 0,10 mL. W tym pierwszym laboratorium, miareczkowanie musi się zgadzać w granicach 0,50 mL.
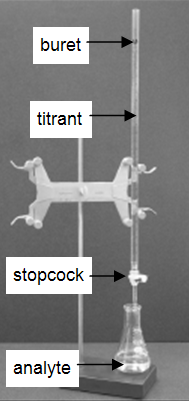
Rysunek 1: Ustawienie miareczkowania
Często punkt równoważności jest określany wizualnie za pomocą wskaźnika. Wskaźnik, który jest substancją zmieniającą kolor w pobliżu punktu równoważności, dodaje się do roztworu analitu. Ponieważ zmiana koloru jest bliska, ale nie dokładnie w punkcie równoważności, punkt, w którym następuje zmiana koloru, nazywa się punktem końcowym. Wskaźniki dobiera się tak, aby punkt końcowy znajdował się bardzo blisko punktu równoważności. Ważne jest, aby miareczkowanie było dobrze wymieszane, tak aby titrant i analit mogły się ze sobą zetknąć i szybko zareagować. Można do tego celu wykorzystać ręczne mieszanie kolby lub mieszanie mechaniczne. W tym eksperymencie użyjesz mieszania ręcznego. Pamiętaj o ciągłym mieszaniu, aby zapewnić całkowite wymieszanie roztworów.Najbardziej powszechnym typem miareczkowania jest miareczkowanie kwasowo-zasadowe. W tym doświadczeniu określisz stężenie kwasu octowego HC2H3O2 w komercyjnym occie. W tym miareczkowaniu titrantem jest wodny NaOH, a analitem ocet. Zakładamy, że silna zasada i słaby kwas reagują całkowicie zgodnie z równaniem netto:
Równanie równowagi wykazuje stechiometrię 1:1, więc możemy napisać:
Mole zasady można obliczyć z molarności razy objętość
Jako przypomnienie jednostek stężenia, molowość jest definiowana jako liczba moli solutu w litrze roztworu (M = mol/L). Liczbowo jest to równe liczbie milimoli rozpuszczalnika w mililitrze roztworu (M = mmol/mL). Często wygodnie jest używać tej drugiej definicji molowości w miareczkowaniu i innych pracach, w których chodzi o małe ilości. W 1 molu znajduje się 1000 mmol, a w 1 litrze 1000 mL. Na przykład, 10,2 mL 0,100 M roztworu NaOH zawiera 1,02 mmol NaOH.
0.100 mmol NaOH
1 mol roztworu
= 1,02 mmol NaOH
Molowość kwasu można obliczyć na podstawie moli podzielonych przez objętość
umieszcza się w kolbie i oznacza masę. Następnie próbkę octu miareczkuje się roztworem NaOH o znanym stężeniu
i określa się objętość roztworu NaOH wymaganą do osiągnięcia punktu końcowego
.
i
są znane, więc stężenie kwasu
może być określone jak opisano powyżej. Ponadto, masa kwasu octowego w próbce może być określona na podstawie liczby obecnych moli i masy molowej kwasu octowego
Wreszcie, procent masowy kwasu octowego w occie może być określony na podstawie masy kwasu octowego w próbce i masy roztworu octu, który został zmiareczkowany.
masa kwasu octowego w próbce
masa miareczkowanego roztworu octu
× 100
W miareczkowaniu kwasu octowego wodnym NaOH jako wskaźnik stosuje się fenoloftaleinę. Fenoloftaleina jest prawie bezbarwna w roztworze kwaśnym, ale zmienia kolor na różowy przy pH około 8. Wskazuje to, że zasada zneutralizowała cały kwas. Podczas miareczkowania octu można zauważyć, że różowy kolor jest bardziej trwały w miarę dodawania kolejnych porcji zasady. Jest to sygnał, aby zwolnić tempo dodawania zasady i kontrolować je dokładnie. Punkt końcowy został osiągnięty, gdy słaby różowy kolor utrzymuje się przez co najmniej 30 sekund. Łatwo jest przekroczyć punkt końcowy. Jeśli tak się stanie, uzyskasz ciemny fioletowo-różowy roztwór i będziesz musiał powtórzyć miareczkowanie, więc bądź ostrożny. Zanotuj zużytą objętość, nie przekraczaj tej objętości w kolejnych miareczkowaniach i dodawaj ostatni mililitr lub więcej kroplami. Instruktor pokaże Ci jak kontrolować kurek biurety, aby to ułatwić. Zauważ, że pomiary objętości w miareczkowaniu są zwykle podawane z dokładnością do czterech cyfr znaczących, tak więc stężenia są zwykle również podawane z dokładnością do czterech cyfr znaczących. Zwróć na to uwagę w swojej pracy; kiedy obliczasz masę molową, upewnij się, że masz cztery cyfry znaczące.
Cele
Podczas tego badania będziesz:
-
1
Standaryzować roztwór NaOH(aq).
-
2
Miareczkować próbkę octu mianowanym roztworem NaOH(aq).
-
3
Zmierzyć gęstość próbki octu.
-
4
Obliczyć molarność i procent masowy kwasu octowego w próbce octu.
Materiały dostępne do użycia
- Ocet
- Roztwór NaOH(aq)
- KHP – wodorofosforan potasu
- Wskaźnik fenoloftaleinowy
- Pipety 10 ml
- Zlewki
- Kolby Erlenmeyera, 125 mL
- Stojak na biurety z biuretą
- Funnel
- Wagi analityczne
Środki ostrożności
Rozpoczęcie
Twoim pierwszym zadaniem jest standaryzacja roztworu NaOH przy użyciu stałego KHP (KC8H5O4, 204,22 g/mol). Oznacza to, że musisz określić jego molowość z dokładnością do co najmniej trzech cyfr znaczących. Będziesz potrzebował co najmniej trzech miareczkowań, które będą zgodne w granicach 1%, zgodnie z procedurą. W laboratorium masz jeszcze dwa inne zadania do wykonania. Musisz wyznaczyć gęstość roztworu octu i molowość kwasu octowego w occie. Na podstawie tych danych można obliczyć procent masowy kwasu octowego.Aby wykonać zadania, trzeba będzie wykonać bardzo dokładne pomiary objętości i masy. Do dokładnego odmierzania objętości przydatne są biurety i pipety. Biureta i pipeta zostały opisane we wstępie i na filmach. Zanim zaczniesz, upewnij się, że rozumiesz ich prawidłowe użycie.
Procedura
Proszę wydrukować arkusz do tego laboratorium. Arkusz ten będzie potrzebny do zapisywania danych.

Przygotowanie biurety
Sprawdź biuretę przepłukując jej boki butelką z wodą destylowaną, aby sprawdzić czy woda „spływa” do wnętrza biurety. Jeśli zaobserwowano kropelki wody, biureta powinna być umyta przed użyciem. Należy uważać, aby nie porysować wewnętrznej powierzchni, jeśli konieczne jest użycie szczotki do czyszczenia biurety. Dobrze wypłukać biuretę wodą z kranu, łącznie z korkiem i spryskiwaczami. Następnie spłukać ścianki biurety wodą dejonizowaną/destylowaną.
Na koniec przepłukać biuretę co najmniej DWUKROTNIE małymi porcjami roztworu NaOH, aby upewnić się, że cała woda została usunięta. Wypuścić roztwór przez końcówkę.
Wypełnić biuretę roztworem NaOH przy użyciu lejka.
Aby USUNĄĆ ZATRZYMANE PĘCHERZYKI POWIETRZA w końcówce biurety po napełnieniu, SZYBKO OTWORZYĆ I ZAMKNĄĆ KUREK ZATRZYMUJĄCY kilka razy. Uwaga: Jeśli korek jest prawidłowo ustawiony w stosunku do końcówki biurety, uwięzione pęcherzyki powietrza nie są tak częste. Sprawdź z instruktorem, jeśli pęcherzyki się utrzymują.
Standaryzacja z KHP
Użyć ~1 grama KHP. NATYCHMIAST ZAPISAĆ MASĘ W TABELI DANYCH.
Użyć butelki do przemywania wodą destylowaną, aby upewnić się, że wszystkie próbki zostały przeniesione do kolby.
Dodać około 50 mL wody destylowanej i dwie lub trzy krople wskaźnika. Wskaźnik fenoloftaleina będzie używany w tym eksperymencie miareczkowania. Nie należy używać zbyt dużej ilości wskaźnika, w przeciwnym razie będzie się miareczkować również tę cząsteczkę. Bądź konsekwentny w używaniu tej samej liczby kropli we wszystkich próbkach.
Technika miareczkowania
Umieścić arkusz białego papieru pod kolbą odbieralnika, aby łatwiej obserwować punkt końcowy.
Użyj podzielonej białej górnej/czarnej dolnej karty, aby ułatwić odczyt menisku. Umieszczenie karty za biuretą i czarnej linii tuż poniżej menisku przyciemnia menisk dla łatwiejszego odczytu. Zanotować początkową objętość roztworu NaOH z dokładnością do co najmniej jednej setnej mililitra (±0,01 ml) w tabeli danych w notatniku.
Titrant (roztwór NaOH w biurecie) może być początkowo dodawany dość szybko, ale w miarę zbliżania się do punktu końcowego tempo dodawania powinno być spowolnione. Jeżeli jesteś praworęczny, szybciej jest dodawać titrant lewą ręką, mieszając prawą (odwrotnie dla osób leworęcznych). W miarę zbliżania się do punktu końcowego, różowy kolor będzie utrzymywał się coraz dłużej. W pobliżu punktu końcowego, spłukać ścianki kolby wodą destylowaną, aby upewnić się, że cała dodana zasada NaOH weszła w reakcję.
Twoja grupa musi wykonać MINIMUM CZTERY PRÓBY, a trzy próby muszą się zgadzać w zakresie ±1%. W rzeczywistości możesz wykonać więcej prób w zależności od techniki. NIE MOŻESZ PO PROSTU „WYKREŚLIĆ” DANYCH, PONIEWAŻ CI SIĘ NIE PODOBAJĄ; MUSISZ WSKAZAĆ POWÓD ODRZUCENIA. Powód może być oczywisty, taki jak „przekroczenie punktu końcowego” lub możesz być w stanie odrzucić wartość tylko w oparciu o testy statystyczne.
Molarność kwasu octowego w occie
Odmierzyć 10 mL octu do kolby Erlenmeyera i dodać wskaźnik fenoloftaleinowy.
Miareczkować za pomocą wzorcowego NaOH z poprzedniego laboratorium.
Interaktywna sesja plakatowa
Po zakończeniu pracy przez grupę przygotuj tablicę, którą możesz wykorzystać do podzielenia się i uzasadnienia swoich pomysłów. Zobacz dostarczony podręcznik, aby uzyskać szczegóły na temat tego procesu.
Raport
Po zakończeniu badań, będziesz musiał przygotować raport z badania, który składa się z trzech części. Raport ten może wymagać więcej niż dwóch stron z tabelami danych. Raport musi być napisany na maszynie, a wszelkie diagramy, rysunki i tabele powinny być osadzone w dokumencie.
- Sekcja 1: Jaką koncepcję i/lub technikę badałeś/aś i jak odnosi się ona do pytania przewodniego? Jakie czynniki decydują o tym, jak dokładnie i jak precyzyjnie można określić stężenie kwasu octowego w occie? Opisz miareczkowanie i jego zastosowanie w połączeniu ze stechiometrią molową do określania stężenia.
- Sekcja 2: Jak zabrałeś się do pracy i dlaczego przeprowadziłeś swoje dochodzenie w ten sposób? W szczególności, jakie środki podjęte w celu zapewnienia dokładności i precyzji?
- Sekcja 3: Argument w tym dochodzeniu nie jest tak bardzo dla wyniku, ale dla ważności i wiarygodności danych. Raport ten powinien zawierać kompleksową tabelę danych, podobną do tej, której używałeś w ćwiczeniu pre-lab, gdzie znalazłeś molarność swojej bazy. Nie należy raportować procesu standaryzacji bazy, poza raportem molarności NaOH z odchyleniem standardowym. Należy podać uzasadnienie odrzucenia którejkolwiek z prób miareczkowania octu. Należy przedstawić jedno pełne obliczenie molowości i masy % octu. Twoja ostateczna odpowiedź dla molarności octu powinna zawierać odchylenie standardowe.
- Ta trzecia sekcja to miejsce, gdzie nie tylko prezentujesz swoje dane, ale używasz wartości, które otrzymujesz jako dowód w swoim rozumowaniu. Stwierdzenia typu: „patrz tabela danych dla wartości” są niedopuszczalne!