Po raz pierwszy odkryty w 1961 r., aż do lat 70. amiodaron był stosowany ze względu na swoje właściwości antyarytmiczne, choć oficjalnie dopiero od 1985 r., kiedy to Stany Zjednoczone ostatecznie zatwierdziły jego stosowanie. Food and Drug Administration (FDA) była niechętna do zatwierdzenia leku z powodu początkowych doniesień o zwiększonej częstości występowania niepożądanych efektów płucnych. Europejskie firmy farmaceutyczne rozpoczęły rozmowy z tą instytucją w połowie lat 80. i zagroziły wstrzymaniem (bezpłatnych) dostaw leku dla amerykańskich lekarzy, jeśli FDA nie wyda oficjalnej zgody. Zezwolenie zostało ostatecznie wydane w grudniu 1985 roku, co czyni go jednym z niewielu leków zatwierdzonych przez FDA bez wcześniejszych randomizowanych badań klinicznych.
I – Mechanizm działania i efekty farmakologiczne
Dwa atomy jodu zawarte w cząsteczce amiodaronu, pochodnej benzofuranu, są kluczowe dla jego właściwości antyarytmicznych. Używając klasyfikacji Vaughana-Williamsa leków antyarytmicznych, amiodaron przedłuża fazę 3 potencjału czynnościowego komórek serca, a także posiada wszystkie cechy elektrofizjologiczne klasy 4.
Absorpcja jest bardzo powolna, a biodostępność jest również niska i zmienna. Z drugiej strony, lek wiąże się całkowicie z białkami osocza i ma dużą objętość dystrybucji. Jest on następnie metabolizowany w wątrobie. Klirens jest również niski, a szacowany okres półtrwania eliminacji wynosi 30-180 dni, ze względu na jego metabolit, desethylamiodarone, który powoduje, że lek gromadzi się w tkankach obwodowych, które działają jako rezerwuary ze względu na ich powinowactwo do fosfolipidów wewnątrzizosomalnych. Te ciała inkluzyjne zostały znalezione w płucach, wątrobie, sercu, skórze, nabłonku rogówki i nerwach obwodowych, co wyjaśnia jego toksyczne działanie w wielu narządach i proporcjonalną zależność między toksycznością, czasem stosowania i dawką kumulacyjną.
Standardowa dzienna dawka podtrzymująca 200 mg amiodaronu uwalnia 75 mg organicznego jodu. Ważne jest, aby podkreślić, że normalne dzienne zapotrzebowanie na jod wynosi 0,2 do 0,8 mg – ponad 100 razy mniej niż to, co jest dostarczane z amiodaronem.
Niskie dawki amiodaronu (100-300 mg dziennie) są skuteczne w przypadku wielu różnych komorowych i nadkomorowych zaburzeń rytmu, w tym jako część strategii kontroli rytmu u pacjentów z migotaniem przedsionków, zwłaszcza gdy obecna jest strukturalna choroba serca. W przypadku, gdy inne leki nie są w stanie kontrolować arytmii, konieczne jest stosowanie dużych dawek amiodaronu, co prowadzi do zwiększenia częstości występowania poważnych działań niepożądanych.
II – Wpływ terapii amiodaronem na przeżycie w warunkach klinicznych
Opisano szereg działań niepożądanych występujących w miarę upływu czasu, zwłaszcza w przypadku przewlekłego stosowania. Szacuje się, że częstość występowania działań niepożądanych związanych z leczeniem amiodaronem wynosi 15% w pierwszym roku i 50% w przypadku długotrwałego stosowania. Ponadto 20% pacjentów wymaga przerwania terapii z powodu takich działań jak uszkodzenie wątroby, problemy z czynnością tarczycy i przewlekły wycisk płucny, które opisywano u maksymalnie 1% na rok leczenia, przy czym skumulowane uszkodzenia wynoszą od 5% do 10%. Uszkodzenie płuc jest najlepiej poznane: powstaje po długiej ekspozycji na amiodaron (2,3), ale zdarzają się również doniesienia o ostrej toksyczności.
Oto najczęstsze, uboczne działania leku:
a) Płuca
Toksyczność płucna wywołana amiodaronem (APT) jest jednym z najpoważniejszych działań niepożądanych stosowania leku. Częstość występowania wynosi około 5% w przypadku stosowania dawek 400 mg lub większych w ciągu doby. o ciekawe, w badaniu AFFIRM (atrial fibrillation follow-up investigation of rhythm management study) stwierdzono zwiększoną częstość występowania toksyczności płucnej u pacjentów z istniejącą wcześniej chorobą płuc. Jednak śmiertelność z przyczyn płucnych i śmiertelność ogólna nie były wyższe wśród tych pacjentów, w porównaniu z pacjentami bez wcześniej istniejącej choroby płuc.
Mechanizm działania tej patologii może być bezpośredni poprzez uwalnianie wolnych rodników, lub pośredni z nadwrażliwości pacjenta. Czynniki ryzyka związane z tym działaniem niepożądanym nie zostały dobrze zidentyfikowane, ale mogą być związane z dawkami kumulacyjnymi, dawkami dobowymi powyżej 400 mg, zaawansowanym wiekiem i podstawową chorobą płuc.
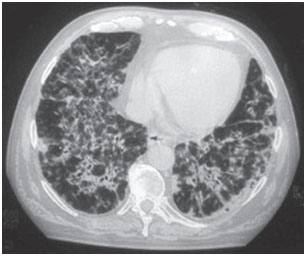
Toksyczność płucna amiodaronu może objawiać się w różny sposób: zapalenie płuc o charakterze śródmiąższowym, zaburzenia oddychania lub pojedyncze masy płucne. Scenariusze kliniczne są zmienne, najczęstszymi objawami są duszność i suchy kaszel, ale objawy mogą również obejmować gorączkę, utratę masy ciała, krwioplucie i ból w klatce piersiowej nasilający się przy ruchach oddechowych. Na radiogramach klatki piersiowej widoczne są nieregularne lub nierównomierne obustronne zmiany naciekowe (ryc. 1 i 2). Testy czynnościowe układu oddechowego wykazują wzorzec restrykcyjny ze zmniejszoną i rozproszoną całkowitą pojemnością płuc. Mechanizm toksyczności płucnej nie został ustalony, ale wydaje się być związany z dawką.
Diagnoza APT jest skomplikowana z powodu niespecyficznych objawów, wyników badań klinicznych oraz wyników badań obrazowych i laboratoryjnych, dlatego jest uważana za rozpoznanie wykluczające. Diagnostyka różnicowa powinna być prowadzona z niewydolnością serca, zapaleniem płuc, zatorowością płucną i chorobą nowotworową. Rokowanie jest korzystne, śmiertelność niska, z wyjątkiem pacjentów, u których wystąpi niewydolność oddechowa, u których śmiertelność zbliża się do 50%. (3)
Leczenie polega na odstawieniu leku i podaniu kortykosteroidów, które powinny być kontynuowane przez kilka miesięcy, mimo początkowo lepszego stanu pacjenta, ponieważ długi okres półtrwania amiodaronu może spowodować ponowne zaostrzenie objawów. Zapobieganie i wczesne wykrywanie tego potencjalnego powikłania wymaga badania radiologicznego klatki piersiowej wykonywanego na początku leczenia, a następnie co roku.
b) Tarczyca
Kliniczne dowody niedoczynności tarczycy występują do 20% pacjentów przyjmujących amiodaron. Amiodaron zapobiega obwodowej konwersji T4 do T3 i zmienia wyniki badań czynności tarczycy. Duże ilości jodu zawarte w amiodaronie mogą tłumaczyć te efekty. iedoczynność tarczycy można łatwo kontrolować za pomocą lewotyroksyny i na ogół nie jest ona powodem do odstawienia amiodaronu. Nadczynność tarczycy występuje u 3% pacjentów w obszarach ubogich w jod, ale u 20% w obszarach, gdzie jod jest wystarczający. Może być trudne do rozpoznania, ponieważ wiele typowych objawów pośredniczących adrenergicznie jest blokowanych przez amiodaron.
W pacjentów przyjmujących amiodaron, pierwszy miesiąc leczenia wykazał wzrost T4 (20%-40%), odwrotnej T3 (20%) i TSH, a spadek T3, który ma tendencję do powrotu do normy w ciągu trzech miesięcy.
W niektórych przypadkach nawrót migotania przedsionków u pacjentów leczonych podtrzymująco amiodaronem wymagał szybkiej oceny w celu wykluczenia nadczynności tarczycy wywołanej amiodaronem.
Zwiększone ryzyko występuje u pacjentów z nieprawidłową wyjściową czynnością tarczycy (choroba autoimmunologiczna, wole) i u osób starszych. Kobiety z dodatnimi przeciwciałami przeciwtarczycowymi są siedmiokrotnie bardziej narażone na to powikłanie.
Zalecamy analizę TSH, T4 i T3 na początku leczenia, po miesiącu leczenia, a następnie co 6 miesięcy.
Diagnoza jest domniemana, gdy występują zwiększone stężenia TSH i zmniejszone T4 i T3. Pragniemy przypomnieć naszym czytelnikom, że wzrost TSH w ciągu pierwszych trzech miesięcy od rozpoczęcia leczenia amiodaronem nie jest problemem samym w sobie, ponieważ może to być zjawisko przejściowe – leczenie amiodaronem może być kontynuowane pod warunkiem dodania lewotyroksyny. Jeśli wartości TSH nie uległy odpowiedniemu obniżeniu, można również czasem dodać trójjodotyroninę. Postępowanie będzie wówczas wymagało pomocy doświadczonego endokrynologa i przerwania terapii amiodaronem. wszystkich pacjentów należy sprawdzić poziom tyreotropiny przed rozpoczęciem leczenia amiodaronem, a następnie co miesiąc.
c) Inne obszary – żołądkowo-jelitowy, wątrobowy, sercowy, okulistyczny, skórny
Zaburzenia żołądkowo-jelitowe, takie jak nudności, wymioty, biegunka lub anoreksja są częste (30%) na początku leczenia. Jednak niektóre z najbardziej obawianych żołądkowo-jelitowych działań niepożądanych – zapalenie wątroby i marskość wątroby – występują rzadko (<3%). Zaleca się badanie czynności wątroby przy rozpoczynaniu leczenia, a następnie co 6 miesięcy. Na początku leczenia zwykle obserwuje się zwiększenie aktywności enzymów wątrobowych; nie zaleca się odstawienia leku, chyba że ich wartości przekraczają dwu- lub trzykrotnie normę. Podwyższenie to, według niektórych autorów, nie wskazuje na konieczność odstawienia leku, niemniej jednak zalecane jest ścisłe monitorowanie.
Działania niepożądane ze strony serca, w tym bradykardię zgłaszano u 5% pacjentów, a polimorficzne komorowe zaburzenia rytmu serca (torsade de pointes) u 1%-2% pacjentów, zwłaszcza wśród osób z czynnikami ryzyka ich wystąpienia. Dlatego EKG powinno być wykonywane na początku leczenia, a następnie co roku. U pacjentów z kardiowerterem-defibrylatorem (ICD) amiodaron może zwiększać długość cyklu częstoskurczów komorowych, co może prowadzić do ich wykrycia i zaburzać skuteczność urządzenia (4).
Wreszcie, spośród innych drobnych działań niepożądanych, u prawie 100% pacjentów otrzymujących ten lek przez ponad 6 miesięcy występują mikrozłogi rogówki. Ich obecność nie wymaga odstawienia leczenia, ponieważ nie są one związane z pogorszeniem ostrości wzroku. Reakcje oczne, takie jak zapalenie nerwu wzrokowego, zanik z utratą wzroku lub oba te objawy, są poważniejsze, ale występują rzadko i nie ma udowodnionej przyczynowości amiodaronu w odniesieniu do nich. Ocena okulistyczna jest wskazana tylko wtedy, gdy występuje deficyt wzroku.
Inne zgłaszane działania niepożądane to nadwrażliwość na światło i niebieska pigmentacja skóry, które ustępują po przerwaniu leczenia. U naszego pacjenta, po wykonaniu różnych badań i podejrzeniu, że obraz kliniczny pacjenta odpowiada TPA, odstawiono amiodaron i rozpoczęto leczenie kortykosteroidami (w dawce 40-60 mg dziennie przez 6 miesięcy). Dzięki temu leczeniu uzyskano zadowalającą poprawę kliniczną i radiologiczną.
Wreszcie amiodaron może powodować hipotensję u około 15% pacjentów otrzymujących go dożylnie. Hipotensję można początkowo leczyć poprzez zmniejszenie szybkości wlewu.
Rys. 1A. Radiogramy posteroanterior klatki piersiowej wykonane w momencie wystąpienia objawów klinicznych i po trzech miesiącach leczenia. Amiodaron nacieka pęcherzykowo-śródmiąższowe obustronne pola płucne podstawne; jednak w trakcie obserwacji media ustąpiły (zdjęcie poniżej).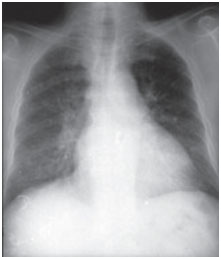
Rysunek 1B. Tomografia komputerowa klatki piersiowej – u tego samego pacjenta, obustronny i rozproszony naciek pęcherzykowo-śródmiąższowy z obszarami bronchogramu powietrznego.
Wykres 1B.